题目内容
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、1mol NH4+与1mol OH-所含的质子数均为10NA |
| B、标准状况下,22.4L CHCl3中含C-H键数目为NA |
| C、常温下,14g乙烯中含碳原子数为NA |
| D、常温下,pH=13的NaOH溶液中含OH-数目为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、1mol铵离子中含有11mol质子,1mol氢氧根离子中含有9mol质子;
B、标况下,三氯甲烷的状态不是气体,不能使用标况下的气体摩尔体积计算三氯甲烷的物质的量;
C、乙烯的摩尔质量为28g/mol,14g乙烯的物质的量为0.5mol,含有1mol碳原子;
D、没有告诉pH=13的NaOH溶液的体积,无法计算该溶液中的氢氧根离子的数目.
B、标况下,三氯甲烷的状态不是气体,不能使用标况下的气体摩尔体积计算三氯甲烷的物质的量;
C、乙烯的摩尔质量为28g/mol,14g乙烯的物质的量为0.5mol,含有1mol碳原子;
D、没有告诉pH=13的NaOH溶液的体积,无法计算该溶液中的氢氧根离子的数目.
解答:
解:A、1mol氢氧根离子含有9mol质子,1mol铵离子含有11mol质子,二者含有的质子数不相等,故A错误;
B、标准状况下,三氯甲烷不是气体,题中条件无法计算22.4L三氯甲烷的物质的量,故B错误;
C、14g乙烯的物质的量为0.5mol,0.5mol乙烯中含有1mol碳原子,含碳原子数为NA,故C正确;
D、氢氧化钠溶液的体积不知,无法计算氢氧化钠溶液中氢氧根离子的物质的量及数目,故D错误;
故选C.
B、标准状况下,三氯甲烷不是气体,题中条件无法计算22.4L三氯甲烷的物质的量,故B错误;
C、14g乙烯的物质的量为0.5mol,0.5mol乙烯中含有1mol碳原子,含碳原子数为NA,故C正确;
D、氢氧化钠溶液的体积不知,无法计算氢氧化钠溶液中氢氧根离子的物质的量及数目,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的关系.

练习册系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A、吸引电子能力的大小顺序一定为Z>Y>W |
| B、原子半径的大小顺序一定为X>Y>Z>W |
| C、Y、Z形成的分子的空间构型可能是正四面体 |
| D、原子核外未成对电子数可能是Z>Y>X>W |
在密闭容器中,反应X2(g)+2Y2(g)?2XY2(g)△H<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是( )
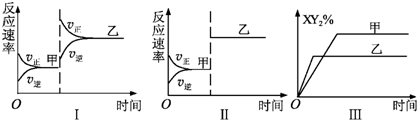

| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |
下列有关实验的叙述,正确的是( )(选填字母序号).
| A、制备乙酸乙酯时,将乙醇和乙酸依次倒入到浓硫酸中 |
| B、用干燥且沽净的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上 |
| C、滴定管洗净后,经蒸馏水润洗即可注入标准液进行滴定 |
| D、铜片跟稀硝酸反应产生的气体可用排水法收集 |
| E、用浓氨水洗涤做过银镜反应的试管 |
| F、在溴水中滴入少量苯酚溶液有白色沉淀生成 |
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )
| A、柠檬酸的电离会抑制碳酸的电离 |
| B、该碳酸饮料中水的电离受到抑制 |
| C、常温下,该碳酸饮料中KW的值大于纯水中KW的值 |
| D、打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
下列各溶液显酸性的是( )
| A、NaHCO3 |
| B、(NH4)2SO4 |
| C、NaCl |
| D、CH3COOK |
下列实验装置或操作设计正确且能达到实验目的是( )
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的氢氧化铁胶体 |
C、 用硫酸标准溶液滴定氢氧化钠溶液 |
D、 称取氢氧化钠固体 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C、c(H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D、与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
