题目内容
1.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质.当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用.(1)NaN3是气体发生剂,受热分解产生Na和N2,其化学方程式是2NaN3═2Na+3N2.
(2)Fe2O3是主氧化剂,与Na发生置换反应,还原产物是Fe(写化学式).
(3)KClO4是助氧化剂,与Na发生氧化还原反应生成KCl和Na2O,其中KClO4中Cl元素的化合价是+7价.
(4)NaHCO3是冷却剂,可以吸收产气过程中释放的热量而发生分解,请写出NaHCO3在水溶液中的电离方程式NaHCO3═Na++HCO3-.
分析 (1)NaN3是气体发生剂,受热分解产生Na和N2,方程式为2NaN3═2Na+3N2;
(2)Fe2O3是主氧化剂,与Na发生置换反应,则还原产物为Fe;
(3)根据KClO4化合价代数和为0计算;
(4)碳酸氢钠在水溶液中的电离生成钠离子和碳酸氢根离子;
解答 解:(1)NaN3是气体发生剂,受热分解产生Na和N2,方程式为2NaN3═2Na+3N2,故答案为:2NaN3═2Na+3N2;
(2)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe,
故答案为:Fe;
(3)KClO4中Cl元素的化合价是+7,
故答案为:+7;
(4)碳酸氢钠在水溶液中的电离生成钠离子和碳酸氢根离子,电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-.
点评 本题以汽车安全气囊的产气药剂为载体,考查化学反应方程式的书写、化合价的计算以及电离方程式等知识,属于拼合型题目,侧重对基础知识的考查.

练习册系列答案
相关题目
11.在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
| A. | NaCl | B. | HC1 | C. | CuSO4 | D. | Na2SO4 |
12.对于下列常见化学问题的认识错误的是( )
| A. | 氯气可用于自来水杀菌消毒 | B. | 干冰能用于人工降雨 | ||
| C. | 碳酸钙是文物陶瓷的主要成分 | D. | 二氧化硫可用于漂白织物 |
9.PH都等于2的盐酸(甲)和醋酸(乙)各100mL 分别与Zn反应,若最后Zn全部溶解且放出气体一样多,则有关叙述正确的是( )
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应所需时间:甲>乙 | |
| C. | 反应开始前,酸的物质的量浓度:甲=乙 | |
| D. | 若使两酸溶液PH都等于5,则加水的体积:甲=乙 |
16.已知下列微粒在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是
( )
( )
| A. | 2Fe2十+Cl2═2Fe3++2Cl- | B. | 2Fe2十+O2═2Fe3++2I- | ||
| C. | I2+SO2+2H2O═H2SO4+2HI | D. | SO2+O2+2H2O═H2O2+H2SO4 |
13.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述正确的是( )
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | D、B简单离子半径大小关系为D3+>B2+ | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | 最高价氧化物对应的水化物的酸性:H2EO4>HFO4 | |
| D. | 气态氢化物的稳定性HG>HF>H2E |

 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH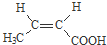 .
. .
.