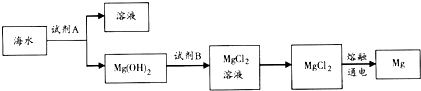
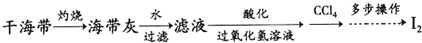题目内容
能说明醋酸是弱电解质的事实是( )
| A、醋酸溶液的导电性比盐酸弱 |
| B、醋酸溶液与CaCO3反应,缓慢放出CO2 |
| C、醋酸溶液用水稀释后,c(H+)下降 |
| D、0.1 mol?L-1的醋酸溶液中c(H+)=0.001 mol?L-1 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:只要能证明醋酸在水溶液里部分电离就能说明醋酸是弱电解质,弱电解质溶液中存在电离平衡.
解答:
解:A.溶液的导电能力与离子浓度成正比,与电解质强弱无关,醋酸溶液的导电性比盐酸弱,只能说明醋酸溶液中离子浓度小于盐酸,但不能说明醋酸的电离程度,所以不能证明醋酸是弱电解质,故A错误;
B.醋酸溶液和碳酸钙反应生成二氧化碳,说明醋酸的酸性大于碳酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故B错误;
C.醋酸溶液用水稀释后,c(H+)下降,不能说明醋酸部分电离,即使强酸稀释时,溶液中氢离子浓度也降低,所以不能据此判断醋酸是弱电解质,故C错误;
D.0.1 mol?L-1的醋酸溶液中c(H+)=0.001 mol?L-1<0.1mol/L,说明醋酸在水溶液里部分电离,能证明醋酸是弱电解质,故D正确;
故选D.
B.醋酸溶液和碳酸钙反应生成二氧化碳,说明醋酸的酸性大于碳酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故B错误;
C.醋酸溶液用水稀释后,c(H+)下降,不能说明醋酸部分电离,即使强酸稀释时,溶液中氢离子浓度也降低,所以不能据此判断醋酸是弱电解质,故C错误;
D.0.1 mol?L-1的醋酸溶液中c(H+)=0.001 mol?L-1<0.1mol/L,说明醋酸在水溶液里部分电离,能证明醋酸是弱电解质,故D正确;
故选D.
点评:本题考查了电解质强弱的判断,根据电解质的电离程度划分电解质强弱,不能根据溶液导电性强弱划分电解质强弱,为易错点.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列离子方程式,正确的是( )
| A、氢氧化铁与盐酸反应:H++OH-═H2O | ||
B、CaCO3溶于稀盐酸中:CO
| ||
| C、铁与H2SO4反应:Fe+2H+═Fe3++H2↑ | ||
| D、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
下列事实(常温下)不能说明醋酸是弱电解质的是( )
| A、醋酸钠溶液pH>7 |
| B、醋酸溶液能溶解碳酸钙 |
| C、0.1mol?L-1醋酸溶液pH=2.9 |
| D、pH=1的醋酸溶液稀释100倍后pH<3 |
 铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )①Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)
②Fe2O3(s)+2H2S(g)+H2(g)?2FeS(s)+3H2O(g)
③FeO(s)+H2S(g)?FeS(s)+H2O(g)
温度与上述各反应的平衡常数的关系如图所示.下列有关说法正确的是( )
| A、反应①、②、③中铁的氧化物都是氧化剂 |
| B、反应①、②、③的正反应都是放热反应 |
| C、反应①、②、③中,温度越高H2S的脱除率越高 |
| D、反应①、②、③中,压强越大H2S脱除率越高 |
在由水电离出的c(H+)=1×10-13 mol/L的溶液中,一定可以大量共存的是( )
| A、Ba2+ Na+ NO3- Cl- |
| B、Fe2+ Na+ NO3- Cl- |
| C、SO42- S2O32- NH4+ Na+ |
| D、Mg2+ Na+ Br- AlO2- |
短周期元素A、B、C,D、E原子序数依次增大,其中A、C同主族,B、E同主族,A的最外层电子数与次外层电子数相等,E是太阳能转化为电能的常用材料,则下列说法正确的是( )
| A、最价氧化物对应水化物碱性强弱:A>C |
| B、C、D的简单阳离子均可促进水的电离 |
| C、B、E的最高价氧化物具有相似的物理性质和化学性质 |
| D、含D的盐溶于水一定显酸性 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、某无色溶液中:Al3+、Cu2+、SO42-、Cl- |
| B、由水电离的c(H+)=1×10-12 mol?L-1的溶液中:Ba2+、K+、Cl-、NO3- |
| C、c(OH-)/c(H+)=1012的溶液中:Na+、Mg2+、NO3-、Cl- |
| D、加入铝单质能放出氢气的溶液中:Mg2+、NH4+、Cl-、K+ |