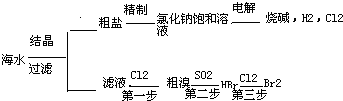
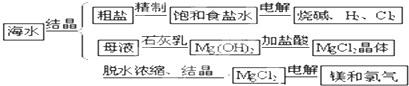
题目内容
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。
按要求回答问题:
(1)浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。下列物质不需要通过化学变化就能够从海水中获得的是 。
A.食盐 B.金属钠 C.淡水
(2)以电解食盐水为基础制取Cl2、 等产品的工业称为“氯碱工业”。
(3)实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号)。
MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号)。
(4)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为: ;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是 (选填下列选项的编号字母)。
(5)电解熔融氯化镁所得的镁蒸气冷却后即为固体镁。下列气体中,镁蒸气可以在其氛围中冷却的是 (选填下列选项的编号字母)。
A.Cl2 B.N2 C.Ar D.空气 E.H2
(12分)(1)AC [2分,答对一个给1分,有错不给分]
(2)H2、NaOH [2分,只写NaOH也给分,写成名称同样给分]
(3) b [ 2分]
(4)2Br— + Cl2 = 2Cl— + Br2, d 。[每空2分]
(5)CE [2分,答对一个给1分,有错不给分]
解析试题分析:(1)食盐和淡水通过蒸发就可以得到,金属钠需要电解才能得到,故选AC。
(2)电解食盐水生成的是Cl2、H2、NaOH,故以电解食盐水为基础制取Cl2、H2、NaOH等产品的工业称为“氯碱工业”。
(3)制取氯气是固体加液体在加热条件下,故选b。
(4)氯气的氧化性大于溴的氧化性,通过置换反应得到溴,离子方程式为)2Br— + Cl2 = 2Cl— + Br2。氯气不稳定且有毒,故选d。
(5)镁可以与Cl2、N2、空气中的氧气和氮气反应,故选CE。
考点:海水资源及其综合利用 氯、溴、碘及其化合物的综合应用 镁、铝的重要化合物
点评:本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力并对课本知识能够牢固的掌握。