题目内容
下表列出了①~⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为 .
(2)元素①和③形成的化合物中的化学键是 共价键(填“极性”或“非极性”).
(3)元素①单质的电子式为 .
(4)元素②~⑤的原子半径由大到小的顺序为(填元素符号) ,它们的最高价氧化物对应的水化物中,酸性最强的是 (填化学式).
(5)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为 ;元素③的最高价氧化物与烧碱溶液反应的离子方程式为 .

请按要求回答下列问题:
(1)元素④的原子结构示意图为
(2)元素①和③形成的化合物中的化学键是
(3)元素①单质的电子式为
(4)元素②~⑤的原子半径由大到小的顺序为(填元素符号)
(5)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤分别是N、Na、Si、S、Cl元素,
(1)元素④的原子核外有3个电子层,K、L、M电子层上电子数分别是2、8、6,据此书写原子结构示意图;
(2)元素①和③形成的化合物是Si3N4,不同非金属元素之间易形成极性共价键;
(3)元素①单质是N2,氮原子之间存在氮氮三键;
(4)同一周期元素中,元素原子半径随着原子序数的增大而减小;同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(5)Na在氧气中燃烧生成Na2O2,Na2O2与CO2反应生成Na2CO3和O2;元素③的最高价氧化物是SiO2,SiO2与烧碱溶液反应生成硅酸钠和水.
(1)元素④的原子核外有3个电子层,K、L、M电子层上电子数分别是2、8、6,据此书写原子结构示意图;
(2)元素①和③形成的化合物是Si3N4,不同非金属元素之间易形成极性共价键;
(3)元素①单质是N2,氮原子之间存在氮氮三键;
(4)同一周期元素中,元素原子半径随着原子序数的增大而减小;同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(5)Na在氧气中燃烧生成Na2O2,Na2O2与CO2反应生成Na2CO3和O2;元素③的最高价氧化物是SiO2,SiO2与烧碱溶液反应生成硅酸钠和水.
解答:
解:根据元素在周期表中的位置知,①②③④⑤分别是N、Na、Si、S、Cl元素,
(1)元素④的原子核外有3个电子层,K、L、M电子层上电子数分别是2、8、6,其原子结构示意图为: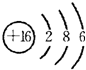 ,
,
故答案为: ;
;
(2)元素①和③形成的化合物是Si3N4,氮化硅中N和Si原子之间存在极性共价键,故答案为:极性;
(3)元素①单质是N2,氮原子之间存在氮氮三键,其电子式为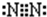 ,故答案为:
,故答案为: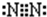 ;
;
(4)同一周期元素中,元素原子半径随着原子序数的增大而减小,所以原子半径大小顺序是Na>Si>S>Cl;同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素非金属性最强的元素是Cl元素,所以酸性最强的酸是HClO4,
故答案为:Na>Si>S>Cl;HClO4;
(5)Na在氧气中燃烧生成Na2O2,Na2O2与CO2反应生成Na2CO3和O2,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;元素③的最高价氧化物是SiO2,SiO2与NaOH溶液反应生成Na2SiO3和H2O,离子反应方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:2Na2O2+2CO2=2Na2CO3+O2;SiO2+2OH-=SiO32-+H2O.
(1)元素④的原子核外有3个电子层,K、L、M电子层上电子数分别是2、8、6,其原子结构示意图为:
 ,
,故答案为:
 ;
;(2)元素①和③形成的化合物是Si3N4,氮化硅中N和Si原子之间存在极性共价键,故答案为:极性;
(3)元素①单质是N2,氮原子之间存在氮氮三键,其电子式为
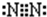 ,故答案为:
,故答案为: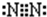 ;
;(4)同一周期元素中,元素原子半径随着原子序数的增大而减小,所以原子半径大小顺序是Na>Si>S>Cl;同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素非金属性最强的元素是Cl元素,所以酸性最强的酸是HClO4,
故答案为:Na>Si>S>Cl;HClO4;
(5)Na在氧气中燃烧生成Na2O2,Na2O2与CO2反应生成Na2CO3和O2,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;元素③的最高价氧化物是SiO2,SiO2与NaOH溶液反应生成Na2SiO3和H2O,离子反应方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:2Na2O2+2CO2=2Na2CO3+O2;SiO2+2OH-=SiO32-+H2O.
点评:本题考查了元素周期表、元素周期律的综合应用,涉及原子结构示意图、电子式、离子方程式的书写及元素周期律,根据物质间的反应结合元素周期律来分析解答,注意氮气分子中氮原子之间存在三对共用电子对,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列关于化学能转化为电能的四种装置的说法正确的是( )
A、 电池中锌是正极 |
B、 电池是一次电池 |
C、 电池工作时,氢气发生还原反应 |
D、 电池工作时,电子由锌通过导线流向碳棒 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、1L1mol?L-1的盐酸溶液中,所含氯化氢分子数为NA |
| B、11.2L氧气中所含有的原子数为NA |
| C、标准状况下,22.4L水所含分子数为NA |
| D、常温常压下,48gO3和O2的混合气体中氧原子数为3NA |
用惰性电极电解一定浓度的硫酸铜溶液,通电2min后,切断电源,向所得溶液中加入0.1mol CuO充分反应后,溶液恰好恢复到电解前的状态.下列说法正确的是( )
| A、阳极上发生氧化反应 |
| B、电解硫酸铜溶液时有氢气生成 |
| C、电解2min的过程中转移电子的物质的量是0.1mol |
| D、电解2min的过程中转移电子的物质的量是0.2mol |


