题目内容
3.04g铜镁合金完全溶解于含1.4molHNO3的浓HNO3中,得到NO2和N2O4混合气2240mL(标准状况下).向反应后的溶液中加入2mol?L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,下列说法不正确的是( )
①该合金中镁与铜的物质的量之比为1:2
②NO2和N2O4的混合气体中,N2O4的体积分数为80%
③得到5.08g沉淀时,加入NaOH溶液的体积是620mL
④该反应中共转移电子为1.2NA.
①该合金中镁与铜的物质的量之比为1:2
②NO2和N2O4的混合气体中,N2O4的体积分数为80%
③得到5.08g沉淀时,加入NaOH溶液的体积是620mL
④该反应中共转移电子为1.2NA.
| A、③ | B、②③④ |
| C、①③ | D、①②③④ |
考点:有关混合物反应的计算
专题:守恒法
分析:金属离子全部沉淀时,得到5.08g沉淀为氢氧化铜、氢氧化镁,计算沉淀中氢氧根的质量,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,根据金属提供的电子物质的量与二者质量之和列方程计算x、y的值.
①该合金中镁与铜的物质的量之比为1:2;
②根据n=
计算NO2和N2O4混合气体的物质的量,令二氧化氮的物质的量为amol,表示出四氧化二氮的物质的量,根据电子转移守恒列方程计算,进而计算N2O4的体积分数;
③得到5.08g沉淀时,溶液中溶质为NaNO3,根据氮元素守恒计算n(NaNO3),根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=
计算需要氢氧化钠溶液的体积;
④结合氢氧根物质的量,计算转移电子数目.
①该合金中镁与铜的物质的量之比为1:2;
②根据n=
| V |
| Vm |
③得到5.08g沉淀时,溶液中溶质为NaNO3,根据氮元素守恒计算n(NaNO3),根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=
| n |
| c |
④结合氢氧根物质的量,计算转移电子数目.
解答:
解:金属离子全部沉淀时,得到5.08g沉淀为氢氧化铜、氢氧化镁,沉淀中氢氧根的质量为5.08g-3.04g=2.04g,氢氧根的物质的量为
=0.12mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,即金属提供电子为0.12mol,
令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
,解得x=0.04 y=0.02,
①故合金中Mg与Cu的物质的量之比是0.02mol:0.04mol=1:2,故①正确;
②标况下,NO2和N2O4混合气体的物质的量为
=0.1mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.1-a)mol,根据电子转移守恒可知,a×1+(0.1-a)×2×1=0.12,解得a=0.08,N2O4的物质的量为0.1mol-0.08mol=0.02mol,N2O4的体积分数=
×100%=20%,故②错误;
③金属离子全部沉淀时,反应后溶质为NaNO3,根据氮元素守恒可知,NaNO3的物质的量为1.4mol-0.08mol-0.02mol×2=1.28mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=1.28mol,故需要氢氧化钠溶液的体积为
=0.64L=640mL,故③错误;
④该反应中共转移电子为0.12NA,故④错误,
故选B.
| 2.04g |
| 17g/mol |
令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
|
①故合金中Mg与Cu的物质的量之比是0.02mol:0.04mol=1:2,故①正确;
②标况下,NO2和N2O4混合气体的物质的量为
| 2.24L |
| 22.4L/mol |
| 0.02mol |
| 0.1mol |
③金属离子全部沉淀时,反应后溶质为NaNO3,根据氮元素守恒可知,NaNO3的物质的量为1.4mol-0.08mol-0.02mol×2=1.28mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=1.28mol,故需要氢氧化钠溶液的体积为
| 1.28mol |
| 2mol/L |
④该反应中共转移电子为0.12NA,故④错误,
故选B.
点评:本题考查混合物的有关计算,难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图.则下列说法不正确的是( )| A、最初20mL NaOH溶液用于中和过量的硫酸 |
| B、原硫酸溶液的物质的量浓度为5 mol/L |
| C、200-240 mL过程中:溶液中只发生Al(OH)3+OH-═AlO2-+2H2O |
| D、生成的氢气在标准状况下的体积为11.2 L |
 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )| A、在t℃时,AgBr的Ksp为4.9×10-13 |
| B、图中b点对应的是向AgBr饱和溶液中加入NaBr固体后的溶液 |
| C、图中a点对应的是AgBr的不饱和溶液 |
| D、AgCl沉淀能较容易转化为AgBr沉淀 |
下列与实验操作或离子检验有关的说法正确的是( )
| A、称量一定质量NaCl固体时,没有用烧杯,直接放在右盘的滤纸上 |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42ˉ |
| C、蒸发时,待水分完全蒸干后才能停止加热 |
| D、加入硝酸酸化的硝酸钡溶液既无沉淀又无气体产生,再加入硝酸银溶液,立刻产生白色沉淀,一定有Clˉ |
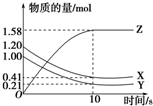 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )| A、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| B、反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C、达平衡时Y的物质的量分数为:9.5% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
下列说法正确的是( )
| A、用Ba(NO3)2溶液鉴别Cl-,CO32-和SO42- |
| B、稀释浓硫酸时,应将浓硫酸沿玻璃棒注入蒸馏水中 |
| C、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定某溶液pH |
| D、检验某溶液中是否含有SO42-时,应取少量该溶液,依次加入氯化钡溶液和稀盐酸 |
不用其它试剂鉴别:①Ba(OH)2②KCl ③Al(NO3)3④Fe2(SO4)3等四种溶液,先直接鉴别出一种,再逐一鉴别其余物质,则正确操作顺序是( )
| A、④②①③ | B、①④③② |
| C、①③④② | D、④①③② |