题目内容
6.室温下,下列溶液中粒子浓度关系正确的是( )| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa与 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
分析 A.铝离子部分水解,溶液显示酸性,则c(H+)>c(OH-),钾离子不水解,则c(K+)>c(Al3+ );
B.根据碳酸氢钠溶液中的电荷守恒分析;
C.根据硫化钠溶液中的质子守恒判断;
D.溶液呈中性,则有c(OH-)=c(H+),再根据混合液中的电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-)和物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH)进行分析.
解答 解:A.KAl(SO4)2溶液中,钾离子和硫酸根离子不水解,而铝离子部分水解,溶液显示酸性,则溶液中离子浓度大小为:c(SO42-)>c(K+)>c(Al3+ )>c(H+)>c(OH-),故A错误;
B.NaHCO3溶液中一定满足电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故B错误;
C.根据Na2S溶液的质子守恒可得:c(OH-)=(H+)+c(HS-)+2c(H2S),则c(OH-)-(H+)=c(HS-)+2c(H2S),故C错误;
D.溶液呈中性,反应后有c(OH-)=c(H+),根据c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-)可知:①c(Na+)=c(CH3COO-)+c(Cl-),根据物料守恒可得:②c(Na+)=c(CH3COO-)+c(CH3COOH),根据①②可得:c(Na+)>c(Cl-)=c(CH3COOH),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,试题涉及盐的水解原理、电荷守恒、物料守恒、质子守恒的应用、离子浓度大小比较等知识,明确电荷守恒、物料守恒、质子守恒的含义为解答关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
10.根据下表中有关短周期元素性质的数据,判断下列说法中正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负价 | -2 | -3 | -1 | -3 | |||||
| A. | 电负性的大小:⑥<②<④<⑤ | |
| B. | 单质熔点的高低:②<⑥ | |
| C. | 第一电离能的大小:③<⑧<⑦<① | |
| D. | 最高价氧化物对应水化物的酸性强弱:④<⑤<⑦ |
14.已知:pAg=-lg[c(Ag-)],Kφ(AgCl)>Kφ(AgI).如图是某温度下向10mLAgNO3溶液中逐滴加入0.1mol•L-1的NaCl溶液中时,溶液的pAg随着加入NaCl溶液的体积变化的图象(曲线①).下列根据图象所得结论不正确的是(溶液混合时体积变化忽略不计)( )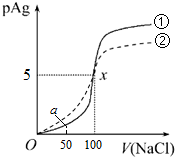

| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | Kφ(AgCl)=1×10-10 | |
| C. | a点时,溶液中c(Cl-)=1.2×10-9mol•L-1 | |
| D. | 若把0.1mol•L-1的NaCl溶液换成0.1mol•L-1的NaI溶液,则pAg的变化图象变成曲线② |
1.Cl2是一种重要的化工原料.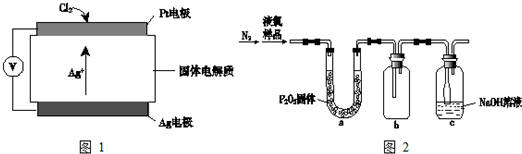
(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O═SO42-+3H++2Cl-
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.

(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.
11.下列有关化学用语或叙述正确的是( )
| A. | C50、N70、C120、C540等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu. |
18.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16下列关于不溶物之间转化说法错误的是( )
| A. | AgI比AgCl更难溶于水,所以AgCl易转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| D. | AgCl不溶于水,不能转化为AgI |
15.水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如下实验:下列判断正确的是.( )
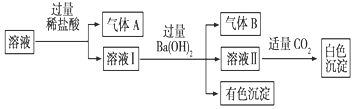

| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+离子 | |
| D. | 溶液中一定不存在大量Na+离子 |
16.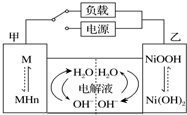 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A. | 在刹车和下坡时,甲电极的电极反应式为:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速时,甲电极周围溶液的pH将减小 | |
| C. | 在上坡或加速时,溶液中的K+向甲电极迁移 | |
| D. | 在刹车和下坡时,乙电极增重 |