题目内容
15.室温下,下列关系正确的是( )| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)=2c(CO32-)+c(HCO3-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)+c(H+)=c(CH3COO-)+c(OH?)+c(Cl-) |
分析 A.氨水溶液中一水合氨存在电离平衡,稀释过程中离子浓度减小,平衡正向进行;
B.溶液中存在质子守恒,水电离出的所有氢离子总和与所有氢氧根离子相同;
C.碳酸钠溶液中碳酸根离子水解溶液显碱性,氢氧根离子浓度大于氢离子浓度,结合电荷守恒分析判断;
D.溶液中存在电荷守恒分析判断;
解答 解:A.加水稀释促进一水合氨电离,pH=a的氨水溶液,稀释10倍后,溶液中的氢氧根离子浓度大于原来的 $\frac{1}{10}$,若其pH=b,则a<b+1,故A错误;
B.Na2C2O4溶液中存在质子守恒:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B正确;
C.碳酸钠溶液中碳酸根离子水解溶液显碱性,溶液中电荷守恒c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-),c(OH-)>c(H+),则c(Na+)>2c(CO32-)+c(HCO3-),故C错误;
D.CH3COONa和CaCl2混合溶液中存在电荷守恒:c(Na+)+2c(Ca2+)+c(H+)=c(CH3COO-)+c(OH?)+c(Cl-),故D错误;
故选B.
点评 本题考查了弱电解质电离平衡影响因素、盐类水解原理、电解质溶液中物料守恒、电荷守恒、质子守恒等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
19.下列表示中不是官能团的是( )
| A. | C=C | B. | C≡C | C. | -CH3 | D. | -X |
10.下列物质在水中可以分层,且上层是水层的是( )
| A. | 苯 | B. | 乙醇 | C. | 溴苯 | D. | 乙酸 |
20.科学家已经合成了元素周期表上的第113号至第119号元素,${\;}_{114}^{263}$X原子在生成数微秒后会衰变成${\;}_{112}^{258}$Y.下列有关叙述中,正确的是( )
| A. | 114号元素衰变成112号元素是化学变化 | |
| B. | 114号元素位于第12列 | |
| C. | ${\;}_{114}^{263}$X的中子数与质子数之差为149 | |
| D. | 112号元素位于周期表第七周期第ⅡB族 |
4.已知C-C键可以绕键轴自由旋转,结构简式如下的烃,下列说法中正确的是( )


| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有8种 | |
| D. | 分子中至少有6个碳原子处于同一直线上 |
5.某高分子化合物的结构简式如图所示,则其单体的名称为( )
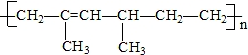

| A. | 乙烯和2-甲基-1,3-戊二烯 | B. | 2,4-二甲基-1,3-己二烯 | ||
| C. | 2,4-二甲基-2-已烯 | D. | 乙烯和2-甲基-1,3-丁二烯 |




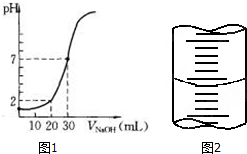 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题: A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
A、B、C、D、E五种物质在一定条件下的转化关系如图所示.