题目内容
关于O2与O3气体,下列比值一定为2:3的是( )
| A、若两种气体所占体积相同,两种气体的质量之比 |
| B、若两种气体原子数相同,两种气体的质子数之比 |
| C、若温度及压强相同,两种气体的密度之比 |
| D、若两种气体的质量相同,两种气体的分子数之比 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.必须是在相同的条件下,气体的体积之比才等于物质的量之比;
B.两种气体原子数相同,质子数相同;
C.根据ρ=
=
计算;
D.根据n=
=
计算.
B.两种气体原子数相同,质子数相同;
C.根据ρ=
| m |
| V |
| M |
| Vm |
D.根据n=
| m |
| M |
| N |
| NA |
解答:
解:A.如不在相同条件下,相同体积的两种气体的物质的量不一定相同,则质量比不一定等于2:3,故A错误;
B.两种气体都有O原子组成,则两种气体原子数相同,两种气体的质子数相同,故B错误;
C.温度和压强相同,Vm相同,由ρ=
=
可知,两种气体的密度之比等于摩尔质量之比等于2:3,故C正确;
D.两种气体的质量相同,由n=
=
可知,两种气体的分子数之比为3:2,故D错误.
故选C.
B.两种气体都有O原子组成,则两种气体原子数相同,两种气体的质子数相同,故B错误;
C.温度和压强相同,Vm相同,由ρ=
| m |
| V |
| M |
| Vm |
D.两种气体的质量相同,由n=
| m |
| M |
| N |
| NA |
故选C.
点评:本题考查阿伏加德罗定律及其推论,题目难度中等,本题注意物质的量的相关计算公式的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、1mol O2与金属钠反应,O2不一定得到4NA个电子 |
| B、标准状况下,a L CH4和a L C6H14中所含分子数均为a NA/22.4 |
| C、常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子 |
| D、在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA |
下列叙述正确的是( )
| A、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| B、增大压强是通过提高活化分子的百分数来提高反应速率 |
| C、氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| D、水煤气是可再生能源 |
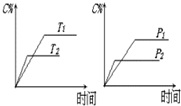 可逆反应a A(s)+b B(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应a A(s)+b B(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,加入催化剂则C%增大 |
| B、达平衡后,若升温,平衡左移 |
| C、化学方程式中b<c+d |
| D、达平衡后,增加A的量有利于平衡向右移动 |