题目内容
3.某含苯环的化合物A因化学反应均能使酸性高锰酸钾溶液和溴水褪色,其相对分子质量为104,碳的质量分数为92.3%.(1)A的分子式为C8H8;
(2)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为90.6%,写出此化合物的结构简式
 .
.(3)已知:
 .请写出A与稀、冷的KMnO4溶液反应生成有机产物与足量醋酸反应的化学方程式为
.请写出A与稀、冷的KMnO4溶液反应生成有机产物与足量醋酸反应的化学方程式为 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.
分析 (1)A分子中N(C)=$\frac{104×92.3%}{12}$=8,N(H)=$\frac{104-12×8}{1}$=8,则分子式为C8H8;
(2)该物质含有苯环,因化学反应均能使酸性高锰酸钾溶液和溴水褪色,说明A应为苯乙烯,与氢气发生加成反应可得乙苯或乙基环己烷,结合含氢量判断;
(3)A中含有C=C,结合信息可知生成物为 ,与乙酸发生酯化反应.
,与乙酸发生酯化反应.
解答 解:(1)A分子中N(C)=$\frac{104×92.3%}{12}$=8,N(H)=$\frac{104-12×8}{1}$=8,则分子式为C8H8,
故答案为:C8H8;
(2)该物质含有苯环,因化学反应均能使酸性高锰酸钾溶液和溴水褪色,说明A应为苯乙烯,结构简式为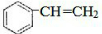 ,与氢气发生加成反应可得乙苯或乙基环己烷,其中乙苯中ω(C)=$\frac{12×8}{12×8+10}$=90.6%,故生成的该化合物为
,与氢气发生加成反应可得乙苯或乙基环己烷,其中乙苯中ω(C)=$\frac{12×8}{12×8+10}$=90.6%,故生成的该化合物为 :
:
故答案为: ;
;
(3)结合信息可知生成物为 ,与乙酸发生酯化反应,与足量醋酸反应的化学方程式为:
,与乙酸发生酯化反应,与足量醋酸反应的化学方程式为: +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为: +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,题目难度中等,注意根据元素的含量和相对分子质量推断A为解答该题的关键.

练习册系列答案
相关题目
13.某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝.查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾.用于有机合成和石油工业的催化剂,以及用于处理润滑油等.他们设计了以下装置(图1),请结合题意回答问题:
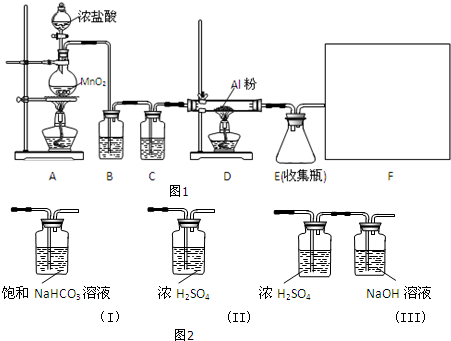
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
(3)请给标记为F的实线方框选择合适的装置(图2)III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合离子方程式说明).
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理.
①经计算,该次滴定测的试样中盐酸浓度为0.2200mol•L-1
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动.有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
(6)工业上常见的制备方法有四种:
a.由金属铝和氯气制取:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3
b.由无水氯化氢气体与熔融金属铝制取:2Al+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2↑
c.用碳氯化法制取:Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO
d.用氧化铝和四氯化碳反应制取:Al2O3+3CCl4═2AlCl3+3COCl2↑(光气,一种无色剧毒气体)
则有关以上四种方法的叙述正确的是CD
A.在四个反应中AlCl3均为氧化产物
B.反应b可以改写成离子方程式2Al+6H+═2Al3++3H2↑
C.反应c中每产生2mol AlCl3时转移电子数为6NA(NA代表阿伏加德罗常数的值)
D.反应c、d容易造成大气污染.

(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
(3)请给标记为F的实线方框选择合适的装置(图2)III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合离子方程式说明).
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理.
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动.有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
(6)工业上常见的制备方法有四种:
a.由金属铝和氯气制取:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3
b.由无水氯化氢气体与熔融金属铝制取:2Al+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2↑
c.用碳氯化法制取:Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO
d.用氧化铝和四氯化碳反应制取:Al2O3+3CCl4═2AlCl3+3COCl2↑(光气,一种无色剧毒气体)
则有关以上四种方法的叙述正确的是CD
A.在四个反应中AlCl3均为氧化产物
B.反应b可以改写成离子方程式2Al+6H+═2Al3++3H2↑
C.反应c中每产生2mol AlCl3时转移电子数为6NA(NA代表阿伏加德罗常数的值)
D.反应c、d容易造成大气污染.
14.某小组在某温度下测定溶液的pH时发现,0.01mol/L的NaOH溶液中,c(H+)•c(OH-)=10-12(mol•L-1)2,则该小组在该温度下测得0.1mol•L的NaOH溶液pH值应为( )
| A. | 13 | B. | 13 | C. | 11 | D. | 10 |
11.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温下,1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 1mol羟基与1mol氢氧根离子所含电子数均为9 NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
18.下列有关实验操作正确的是( )
| A. | 向酒精灯内添加酒精时,不能多于容积的$\frac{2}{3}$,若不慎洒出的酒精在桌上燃烧,应迅速用水扑灭 | |
| B. | 中和滴定实验中,滴定管、锥形瓶用蒸馏水洗净后须再用待装液润洗后方可使用 | |
| C. | 取少量硫酸亚铁铵晶体放入试管,加入适量NaOH溶液,加热试管,在试管口用湿润的蓝色石蕊试纸检验,则可证明硫酸亚铁铵晶体的成分中含有NH4+ | |
| D. | 探究反应速率影响因素的实验中,以Na2S2O3溶液与稀硫酸反应产生沉淀的快慢为依据来比较不同条件下速率的快慢 |
8.下列除去杂质的方法正确的是( )
| A. | 溴苯中混有Br2,将其倒入NaOH溶液中,振荡,静置,分液 | |
| B. | 乙烷中混有乙烯,在一定条件下通入足量的氢气进行反应,使乙烯转化为乙烷 | |
| C. | 乙酸乙酯中混有乙酸,可加入一定量的乙醇,在浓硫酸存在的条件下加热使乙酸酯化 | |
| D. | 乙烯中混有SO2和CO2,将其通入溴水进行洗气 |
12. 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )| A. | 反应过程中,沉淀最多时的质量为78g | |
| B. | 反应过程中,Al3+离子有$\frac{1}{3}$转化为Al(OH)3沉淀,则加入的NaOH溶液的体积可能为3.5L | |
| C. | AlCl3溶液的浓度为2.0 mol/L | |
| D. | 当V(NaOH)=4.0 L时,得到的溶液中Na+、Cl-浓度一定不相等 |







 .
.