题目内容
13.某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝.查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾.用于有机合成和石油工业的催化剂,以及用于处理润滑油等.他们设计了以下装置(图1),请结合题意回答问题: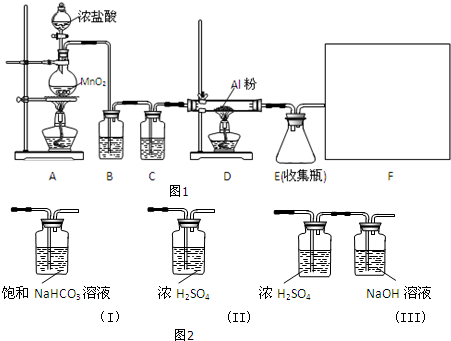
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
(3)请给标记为F的实线方框选择合适的装置(图2)III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合离子方程式说明).
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理.
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动.有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
(6)工业上常见的制备方法有四种:
a.由金属铝和氯气制取:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3
b.由无水氯化氢气体与熔融金属铝制取:2Al+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2↑
c.用碳氯化法制取:Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO
d.用氧化铝和四氯化碳反应制取:Al2O3+3CCl4═2AlCl3+3COCl2↑(光气,一种无色剧毒气体)
则有关以上四种方法的叙述正确的是CD
A.在四个反应中AlCl3均为氧化产物
B.反应b可以改写成离子方程式2Al+6H+═2Al3++3H2↑
C.反应c中每产生2mol AlCl3时转移电子数为6NA(NA代表阿伏加德罗常数的值)
D.反应c、d容易造成大气污染.
分析 浓盐酸和二氧化锰反应生成氯气,B中的饱和食盐水是为了除去混有的HCl气体,C中的浓硫酸是为了除去水,氯气与铝反应生成氯化铝,因为氯化铝易发生水解,故F应该防止空气中的水蒸气进入E装置和吸收尾气.
(1)根据浓盐酸和二氧化锰的性质判断生成物,从而确定方程式;
(2)B中的饱和食盐水是为了除去混有的HCl气体;
(3)F应该防止空气中的水蒸气进入E装置和吸收尾气;
(4)AlCl3遇水水解生成氢氧化铝和氯化氢;
(5)①先求出氢氧化钠的平均体积,由CHClVHCl=CNaOHVNaOH解题;
②根据c(待)=$\frac{c(标)×V(标)}{V(待)}$判断不当操作对相关物理量的影响;
(6)A.化合价升高得到的是氧化产物;
B.氯化氢和氯化铝不电离;
C.Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO,碳总共失去6mol电子;
D.一氧化碳和COCl2有毒.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B中的饱和食盐水是为了除去混有的HCl气体,故答案为:除去Cl2中混有的HCl气体;
(3)F应该防止空气中的水蒸气进入E装置和吸收尾气,应选III,故答案为:III;
(4)AlCl3遇水水解生成氢氧化铝和氯化氢,离子方程式:Al3++3H2O?Al(OH)3+3H+,故答案为:AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾;
(5)①反应消耗的V(NaOH)分别为22.60,22.25-0.5=21.75,22.05-0.7=21.35,23.00-1.00=22.00
平均为$\frac{22.60+21.75+21.35+22}{4}$=22.00mL
该次滴定测得试样中盐酸浓度为,由CHClVHCl=CNaOHVNaOH可得CHCl×20=0.2000×22.00
盐酸的浓度为0.2200mol/L,故答案为:0.2200;
②a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失,标准液题体积偏大,实验结果偏大;
b.未用标准NaOH溶液润洗滴定管,标准液的浓度偏小,体积偏大,实验结果偏大;
c.锥形瓶中加入待测盐酸后,再加少量水,实验结果无影响;
d.有少量液体溅出,溶质的物质的量减小,实验结果偏小;
e.滴定前锥形瓶用待测盐酸润洗,消耗标准液体积偏大,实验结果偏大;
f.观察读数时,滴定前仰视,滴定后俯视,读出体积偏小,实验结果偏小;
故答案为:df;
(6)A.Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO中氯化铝是还原产物,故A错误;
B.氯化氢和氯化铝是共价化合物,不电离,不能书写离子方程式,故B错误;
C.Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO,碳总共失去6mol电子,每产生2mol AlCl3时转移电子数为6NA,故C正确;
D.一氧化碳和COCl2有毒,会造成污染,故D正确.
故答案为:CD.
点评 本题考查了实验室制备氯气,中和滴定的实验操作,侧重实验基本操作和实验原理的考查,题目难度中等,注意把握实验设计的仪器连接顺序,清楚实验原理.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | 物质的量相同的气体单质具有相同的原子数 | |
| B. | 铁原子的摩尔质量等于它的相对原子质量 | |
| C. | 反应前各反应物的物质的量之和一定等于反应后各生成物的物质的量之和 | |
| D. | 一个氧原子的实际质量等于$\frac{16}{6.02×1{0}^{23}}$g |
 S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:①CS2+3Cl2$\stackrel{111-140℃}{→}$CCl4+S2Cl2;②2S+Cl2$\stackrel{95-100℃}{→}$S2Cl2
已知:S2Cl2不稳定,在水中易发生歧化反应(一部分硫元素化合价升高,一部分硫元素化合价降低).
反应涉及的几种物质的熔沸点如下:
| S | CS2 | CCl4 | S2Cl2 | |
| 熔点/ | 113 | -109 | -23 | -77 |
| 沸点/ | 445 | 47 | 77 | 137 |
回答下列问题:
(1)写出A装置中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.如果撤去A装置中酒精灯,若想达到同样的目的,则圆底烧瓶中加入试剂是高锰酸钾(或重铬酸钾,氯酸钾)固体(填写名称).
(2)冷却水进水口是a(填“a”或“b”)
(3)下列均匀为中学教材中的实验,也可以采用类似D装置的冷凝方式的有I、Ⅱ、Ⅳ(填序号)
I.制取溴苯Ⅱ.制取乙酸乙酯Ⅲ.制取氨气Ⅳ.石油分馏
(4)用化学方程式表示撤去C装置的后果2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑;用直接加热替代水浴加热的后果是不易控制温度,温度高时产生副产物,产品纯度降低.
(5)M溶液可以选择下列试剂中的a、c(填序号).
a.碳酸钠溶液 b.氯化铁溶液 c.亚硫酸钠溶液 d.高锰酸钾溶液
(6)实验完毕后,分离产品必需的主要玻璃仪器是蒸馏烧瓶、温度计(填两种仪器名称).

 如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
 (写结构简式)可以合成二肽(如图2)
(写结构简式)可以合成二肽(如图2) A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: .
. .请写出A与稀、冷的KMnO4溶液反应生成有机产物与足量醋酸反应的化学方程式为
.请写出A与稀、冷的KMnO4溶液反应生成有机产物与足量醋酸反应的化学方程式为 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.