题目内容
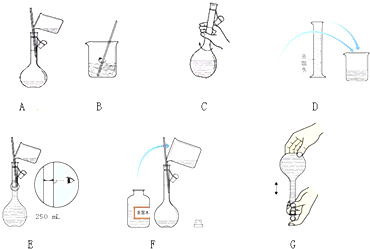
12.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:实验需要90mL 0.1mol/LFeBr2溶液(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是玻璃棒、100mL容量瓶、
(2)下列有关配制过程中说法错误的是abde(填序号).
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高.
分析 (1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管;
(2)a.用电子天平称量质量为应为0.1×0.1×216=2.16g;
b.称量的FeBr2放入烧杯中;
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中;
d.容量瓶不能储存溶液;
e.定容时,仰视容量瓶刻度线会使溶液体积偏大.
解答 解:(1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管,则除烧杯、量筒、胶头滴管外还需的玻璃仪器是玻璃棒、100ml的容量瓶;
故答案为:玻璃棒、100ml的容量瓶;
(2)a.用电子天平称量质量为应为0.1×0.1×216=2.16g,故a错误;
b.称量的FeBr2放入烧杯中,不能放入容量瓶中,加90nL蒸馏水溶解,故b错误;
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中,故c正确;
d.容量瓶不能储存溶液,故d错误;
e.定容时,仰视容量瓶刻度线会使溶液体积偏大,浓度偏低,故e错误;
故选:abde.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,题目难度不大,试题培养了学生的分析能力及化学检验能力.

练习册系列答案
相关题目
6. CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
 CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )| A. | 反应开始2min内平均反应速率最大 | |
| B. | 可用c(Ca2+)或c(H+)的变化表示该反应速率 | |
| C. | 反应4min后平均反应速率减小 | |
| D. | 反应在第2min到第4min间生成CO2的平均反应速率为v${\;}_{C{O}_{2}}$=0.1mol/min |
1.根据下列各图曲线表征的信息,得出的结论不正确的是( )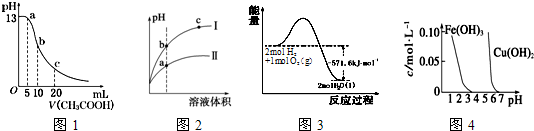

| A. | 图l表示常温下向体积为10mL0.1mol•L-1NaOH溶液中逐滴加入O.1mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) | |
| B. | 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a | |
| C. | 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8kJ.mol-1 | |
| D. | 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的pH至4 |
 .
.
 .
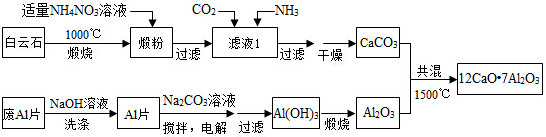
. .
.
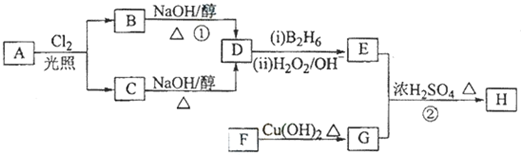
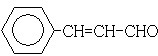 ;
;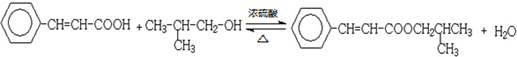 .
.