题目内容
16.铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2.上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O.
(2)在Fe2+或Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知含SO2的废气通入含Fe2+的溶液时,其中一个反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾.利用烧渣制绿矾的过程如下:

①烧渣溶于稀H2SO4过程中,先是固体大部分被溶解,接着有单质硫生成,写出该反应的离子方程式(只写生成S的离子方程式,其他反应无需写出)2Fe3++H2S=2Fe2++S↓+2H+.
②向溶液X中加入足量铁屑的目的是使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体.
③取1.6g所得晶体样品配成溶液,滴入10.00mL 0.1000mol/L 的酸性高锰酸钾液刚好完全反应,经计算可得样品中含47.5%的硫酸亚铁.
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全计算得c(Fe3+)=1.1×10-3mol•L-1>1×10-5mol•L-1,故Fe3+没有沉淀完全.
(提示:当某离子浓度小于1.0×10-5 mol•L-1时可以认为该离子沉淀完全了)
分析 (1)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳;磁性固体能溶于过量稀硝酸发生氧化还原反应生成硝酸铁、NO和水;
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化,由总反应(2SO2+O2+2H2O=2H2SO4)减去4Fe2++O2+4H+=4Fe3++2H2O即可;
(3)①Fe2O3和FeS均可以和稀硫酸之间反应分别生成硫酸铁、硫化氢,二者之间会发生化学反应;
②金属铁可以和铁离子之间反应生成亚铁离子;
③取1.6g所得晶体样品,样品中含47.5%的硫酸亚铁,硫酸亚铁的物质的量为$\frac{1.6g×47.5%}{152g/mol}$=0.005mol,根据反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O计算高锰酸钾溶液的体积;
(4)溶液中c(H+)=10-3,c(OH-)=10-11 ,代入Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+)求算.
解答 解:(1)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳,反应为Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2;磁性固体能溶于过量稀硝酸发生氧化还原反应生成硝酸铁、NO和水,离子反应为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2;3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(2)由总反应(2SO2+O2+2H2O=2H2SO4)减去4Fe2++O2+4H+=4Fe3++2H2O可得到离子反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①Fe2O3可以和稀硫酸之间反应生成硫酸铁,FeS可以和稀硫酸之间反应生成硫化氢,铁离子具有氧化性,硫化氢具有还原性,二者之间会发生化学反应:2Fe3++H2S=2Fe2++S↓+2H+,会产生硫单质,故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
②向溶液硫酸铁中加入足量铁屑,金属铁可以和铁离子之间反应生成亚铁离子,以制备纯净的绿矾晶体,故答案为:使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体;
③取1.6g所得晶体样品,样品中含47.5%的硫酸亚铁,硫酸亚铁的物质的量为$\frac{1.6g×47.5%}{152g/mol}$=0.005mol,根据反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,消耗的高锰酸钾溶液的体积为$\frac{\frac{0.005}{5}mol}{0.1000mol/L}$=0.01L=10.00mL,故答案为:10.00;
(4)溶液pH为3时,溶液中c(H+)=10-3,则c(OH-)=10-11 ,Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+),c(Fe3+)=1.1×10-36/10-33=1.1×10-3(mol/L)>10-5 mol•L-1,故答案为:计算得c(Fe3+)=1.1×10-3mol•L-1>1×10-5 mol•L-1,故Fe3+没有沉淀完全.
点评 本题考查较综合,涉及氧化还原反应的计算、离子反应和化学反应方程式的书写等,综合性较强,侧重分析能力与计算能力的综合考查,题目难度中等.

| A. | 将高温水蒸气通过炽热的铁粉,铁粉变红色 | |
| B. | 向Fe(OH)3胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解 | |
| C. | 向FeCl2溶液中加入几滴KSCN溶液,溶液变为血红色,则FeCl2溶液完全变质 | |
| D. | 铝在空气中耐腐蚀,所以铝是不活泼金属 |
| A. | 生活污水的任意排放 | B. | 所有绿色植物的光合作用 | ||
| C. | 废电池的随意丢弃 | D. | 化肥和杀虫剂的大量使用 |
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
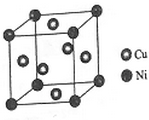 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: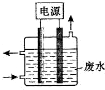
 ,画出表中(3)的微粒结构示意图为
,画出表中(3)的微粒结构示意图为 .
.