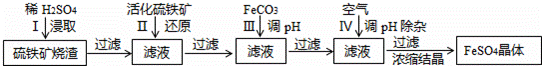
题目内容
7.实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气.取一定量的浓盐酸使其与二氧化锰发生反应,当有29.2gHCl参加反应时,请回答:(1)生成的氯气在标准状况下的体积?
(2)将Cl2全部用Ca(OH)2吸收,可得漂白粉多少克?
分析 (1)发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O,计算HCl物质的量,根据方程式计算生成氯气物质的量,再根据V=nVm计算生成氯气体积;
(2)发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据方程式计算可得漂白粉的质量.
解答 解:(1)29.2g HCl的物质的量为$\frac{29.2g}{36.5g/mol}$=0.8mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O
4 1
0.8mol n(C12)
所以n(C12)=$\frac{0.8mol×1}{4}$=0.2mol
则V(C12)=0.2mol×22.4L/mol=4.48L
答:标况下生成氯气体积为4.48L;
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 111g 143g
0.2mol 11.1g 14.3g
则所得漂白粉的质量为11.1g+14.3g=25.4g
答:漂白粉质量为25.4克
点评 本题考查化学方程式的计算,题目难度不大,明确发生的反应即可解答,(2)为易错点,学生容易忽略氯化钙.

练习册系列答案
相关题目
18.对于反应2KMnO4$\stackrel{△}{→}$K2MnO4+MnO2+O2↑,下列说法错误的是( )
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
15.下列实验操作正确的是( )
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
2.下列说法正确的是( )
| A. | 胶体粒子很小,可以透过半透膜 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| D. | 豆浆、雾、有色玻璃都是胶体 |
12.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)写出BA3的电子式: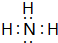 .
.
(2)B元素基态原子中能量最高的电子,其电子云在空间有3个取向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为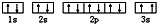 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
(4)比较B和D的电负性N>P(填元素符号)
(5)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(6)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
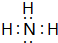 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个取向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
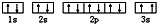 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)比较B和D的电负性N>P(填元素符号)
(5)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(6)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
19.室温下等体积混合0.12mol•L-1的盐酸和0.05mol•L-1的Ba(OH)2溶液后,溶液的pH等于( )
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |