题目内容
NA代表阿伏加德罗常数,下列说法中不正确的是( )
| A、15 g甲基(-CH3)所含电子总数为9NA |
| B、标准状况下,22.4L水中所含有的分子数为NA |
| C、0.8 mol乙烷中含4.8NA个氢原子 |
| D、电解氧化铝时,若阴极生成54g铝,则阳极产生1.5NA个氧气分子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量结合甲基结构计算电子数;
B、标准状况水不是气体;
C、依据乙烷分子式计算氢原子数;
D、依据电解氧化铝电极反应和电子守恒计算生成氧气分子数.
| m |
| M |
B、标准状况水不是气体;
C、依据乙烷分子式计算氢原子数;
D、依据电解氧化铝电极反应和电子守恒计算生成氧气分子数.
解答:
解:A、15 g甲基(-CH3)物质的量=
=1mol,所含电子总数为9NA,故A正确;
B、标准状况水不是气体,22.4L水不是1mol,故B错误;
C、0.8 mol乙烷C2H6,分子中含4.8NA个氢原子,故C正确;
D、电解氧化铝时,若阴极生成54g铝物质的量为2mol,Al-3e-=Al3+,电子转移守恒得到,2O2-+4e-=O2↑则阳极产生1.5NA个氧气分子,故D正确;
故选B.
| 15g |
| 15g/mol |
B、标准状况水不是气体,22.4L水不是1mol,故B错误;
C、0.8 mol乙烷C2H6,分子中含4.8NA个氢原子,故C正确;
D、电解氧化铝时,若阴极生成54g铝物质的量为2mol,Al-3e-=Al3+,电子转移守恒得到,2O2-+4e-=O2↑则阳极产生1.5NA个氧气分子,故D正确;
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件分析,气体摩尔体积的条件应用,电解原理的计算分析,题目难度中等.

练习册系列答案
相关题目
牙齿表面由一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s)═5Ca2+ (aq)+3PO43- (aq)+OH-(aq)
已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,以下措施中能保护牙齿的是( )
Ca5(PO4)3OH(s)═5Ca2+ (aq)+3PO43- (aq)+OH-(aq)
已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,以下措施中能保护牙齿的是( )
| A、多饮纯净水 |
| B、在牙膏中添加适量的Ca2+或PO43-离子 |
| C、在饮用水中加入柠檬片 |
| D、在牙膏中加入适量的氟化物添加剂 |
在0.1mol?L-1的CH3COONa溶液中离子浓度关系正确的是( )
| A、c(Na+)>c(OH)>c(CH3COO-)>c(H+) |
| B、c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、c(Na+)+c(CH3COO-)=c(OH-)+c(H+) |
下列各组离子中在碱性溶液中能大量共存的是( )
| A、K+、Al3+、Cl-、SO42- |
| B、Na+、AlO2-、NO3-、CO32- |
| C、NH4+、Mg2+、NO3-、SO42- |
| D、Na+、H+、SO42-、Cl- |
下列反应的离子方程式正确的是( )
| A、等物质的量是Ba(OH)2与NH4HSO4的稀溶液反应:Ba2+2OH-+2H+SO42-=BaSO4↓+2H2O |
| B、向硫酸铜溶液中加入足量的氢氧化钡溶液Ba2++SO42-═BaSO4↓ |
| C、向碳酸氢钠溶液中滴入过量石灰水HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HC03-+Ca2++2OH-═MgCO3↓+MgCO3↓+2H2O |
下列离子方程式中,正确的是( )
| A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O |
| B、钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
| C、Cl2与水反应 Cl2+H2O═Cl-+ClO-+2H+ |
| D、F2与NaOH溶液反应 2F2+4OH-═4F-+O2+2H2O |
下列关于各装置图的叙述中,不正确的是( )
A、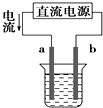 如图装置中a为阳极、b为阴极 |
B、 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
C、 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
D、 如图装置中的铁钉几乎不被腐蚀 |
 氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.