题目内容
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料.
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
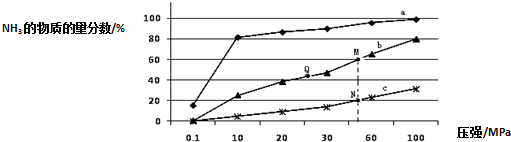
①曲线a对应的温度是 .
②关于工业合成氨的反应,下列叙述正确的是 (填字母).
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③M点对应的H2转化率是 .
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气.
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8L SO2时,溶液中的溶质为 .
②NH4HSO3溶液显酸性.用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母).
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液.
②空气在进入电池装置前需要通过过滤器除去的气体是 .
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 .
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.

①曲线a对应的温度是
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③M点对应的H2转化率是
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气.
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8L SO2时,溶液中的溶质为
②NH4HSO3溶液显酸性.用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择
②空气在进入电池装置前需要通过过滤器除去的气体是
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是
考点:化学平衡的影响因素,原电池和电解池的工作原理
专题:
分析:(1)①合成氨反应放热,温度越低氨气的百分含量越高;
②A、减小生成物浓度平衡正向移动;B、催化剂不影响平衡移动;C、K只受温度影响,该反应温度升高时K值减小;
③利用α(H2)=
求算;
(2)①氨的物质的量为3mol,吸收标准状况下44.8L SO2时.N原子3mol,S原子2mol,据原子守恒,在(NH4)2SO3中,其原子个数比N:S=2:1,在中,NH4HSO3,其原子个数比N:S=1:1,据此分析;
②利用电荷守恒原理解答;
(3)①氨气是碱性气体;②空气中的CO2能和氨水反应;③正极发生氧化反应,氧气在正极反应,注意时碱性环境.
②A、减小生成物浓度平衡正向移动;B、催化剂不影响平衡移动;C、K只受温度影响,该反应温度升高时K值减小;
③利用α(H2)=
| n(转化) |
| n(起始) |
(2)①氨的物质的量为3mol,吸收标准状况下44.8L SO2时.N原子3mol,S原子2mol,据原子守恒,在(NH4)2SO3中,其原子个数比N:S=2:1,在中,NH4HSO3,其原子个数比N:S=1:1,据此分析;
②利用电荷守恒原理解答;
(3)①氨气是碱性气体;②空气中的CO2能和氨水反应;③正极发生氧化反应,氧气在正极反应,注意时碱性环境.
解答:
解:(1)①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是200℃,故答案为:200℃;
②A、减小生成物浓度平衡正向移动,及时分离出NH3可以提高H2的平衡转化率,故A正确;
B、催化剂不影响平衡移动,加催化剂能加快反应速率但不能提高H2的平衡转化率,故B错误;
C、K只受温度影响,该反应温度升高时K值减小,b是400℃,c是600℃,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
故选:AC;
③3N2(g)+3H2(g) 2NH3(g)
2NH3(g)
反应前(mol) 1 3 0
反应了(mol) x 3x 2x
平衡时(mol) 1-x 3-3x 2x
据题意M点时:
=60%
x=
,
则氢气的转化率为:
×100%=75%,故答案为:75%;
(2)①氨的物质的量为3mol,吸收标准状况下44.8L SO2时.N原子3mol,S原子2mol,据原子守恒,在(NH4)2SO3中,其原子个数比N:S=2:1,在中,NH4HSO3,其原子个数比N:S=1:1,所以,生成物有(NH4)2SO3和NH4HSO3,故答案为:(NH4)2SO3和NH4HSO3;
②据电荷守恒有:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性,则,c(H+)=c(OH-),故a正确,b正确,c错误,故选:ab;
(3)①氨气是碱性气体,所以电解液最好选择碱性的,故答案为:碱性;
②空气中的CO2能和氨水反应,所以,滤去的气体是CO2,故答案为:CO2;
③正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
②A、减小生成物浓度平衡正向移动,及时分离出NH3可以提高H2的平衡转化率,故A正确;
B、催化剂不影响平衡移动,加催化剂能加快反应速率但不能提高H2的平衡转化率,故B错误;
C、K只受温度影响,该反应温度升高时K值减小,b是400℃,c是600℃,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
故选:AC;
③3N2(g)+3H2(g)
 2NH3(g)
2NH3(g)反应前(mol) 1 3 0
反应了(mol) x 3x 2x
平衡时(mol) 1-x 3-3x 2x
据题意M点时:
| 2x |
| 1-x+3-3x+2x |
x=
| 3 |
| 4 |
则氢气的转化率为:
3×
| ||
| 3 |
(2)①氨的物质的量为3mol,吸收标准状况下44.8L SO2时.N原子3mol,S原子2mol,据原子守恒,在(NH4)2SO3中,其原子个数比N:S=2:1,在中,NH4HSO3,其原子个数比N:S=1:1,所以,生成物有(NH4)2SO3和NH4HSO3,故答案为:(NH4)2SO3和NH4HSO3;
②据电荷守恒有:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性,则,c(H+)=c(OH-),故a正确,b正确,c错误,故选:ab;
(3)①氨气是碱性气体,所以电解液最好选择碱性的,故答案为:碱性;
②空气中的CO2能和氨水反应,所以,滤去的气体是CO2,故答案为:CO2;
③正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
点评:本题考查了电化学、热化学、化学平衡、电解质溶液以及气体的制取等等,考查范围广,问题跨度大,难度一般,需要学生在学习过程中抓住基础.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列各组离子在酸性溶液中可以大量共存的是( )
| A、Ba2+ NO3- NH4+ |
| B、Na+ K+ SO32- |
| C、Ca2+ CO32- Cl- |
| D、ClO- Na+ NH4+ |
一定量的CuS投入足量的HNO3中,收集到气体V L(标准状况),已知气体为NO和NO2的混合物,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,则V可能为( )
| A、5.0L | B、8.9L |
| C、15.7L | D、26.9L |
在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
| A、2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | ||||
| B、S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)═2HCl(g);△H1
|
氮化铝(AlN)是一种新型陶瓷材料.可通过如下反应制备:Al2O3+N2+3C
2AlN+3CO.关于该反应的说法正确的是( )
| ||
| A、该反应是复分解反应 |
| B、Al2O3 是氧化剂 |
| C、N2发生还原反应 |
| D、每反应1molN2转移3mol电子 |

 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和