题目内容
在化学反应2H2O2═2H2O+O2中,H2O2中的氧元素( )
| A、只是被氧化 |
| B、只是被还原 |
| C、既被氧化又被还原 |
| D、以上都不是 |
考点:氧化还原反应
专题:
分析:该反应双氧水中O元素化合价由-1价变为0价和-2价,得电子化合价降低的元素被还原,失电子化合价升高的元素被氧化,据此分析解答.
解答:
解:该反应双氧水中O元素化合价由-1价变为0价和-2价,得电子化合价降低的元素被还原,失电子化合价升高的元素被氧化,所以双氧水中的氧元素既被氧化又被还原,故选C.
点评:本题考查氧化还原反应,侧重考查基本概念,明确元素化合价变化是解本题关键,注意双氧水、过氧化钠中氧元素化合价,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )


| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的KSP约等于6.25×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
在高炉中,氧化铁被还原成铁,还原剂是( )
| A、焦炭 | B、铁矿石 |
| C、石灰石 | D、一氧化碳 |
一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,下列关于此燃料电池的有关说法中错误的是( )
| A、通过甲烷的电极X为电池的负极,通过氧气的电极Y为电池正极 |
| B、放电一段时间后,电解质溶液中KOH的物质的量改变 |
| C、在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移 |
| D、放电时,通过甲烷的一极附近的pH升高 |
当光束通过豆浆时,可观察到丁达尔效应,表明豆浆是( )
| A、胶体 | B、溶液 |
| C、悬浊液 | D、乳浊液 |
NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,22.4LCO2中含有NA个CO2分子 |
| B、1.7 gH2O2中含有电子数为0.9NA |
| C、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| D、分子总数为NA的CO和C2H4混合气体体积约为22.4L则质量为28g |
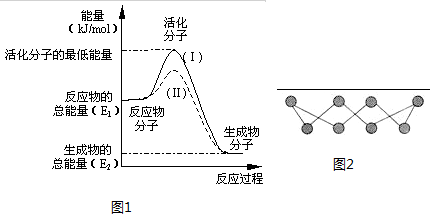 在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.
在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.