题目内容
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中不正确的有( )
| A、标准状况下,20 g重水(D2O)中含有的电子数为10NA |
| B、乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
| C、22.4 L的N2的共用电子对数为3NA |
| D、78gNa2O2固体中含有的阴离子数为NA |
考点:阿伏加德罗常数
专题:
分析:A、D2O中含有10个电子,摩尔质量是20g/mol;
B、乙烯和环丙烷最简式相同为CH2,计算42gCH2中氢原子数;
C、氮气所处的状态不确定;
D、Na2O2由2个Na+和1个O22-构成
B、乙烯和环丙烷最简式相同为CH2,计算42gCH2中氢原子数;
C、氮气所处的状态不确定;
D、Na2O2由2个Na+和1个O22-构成
解答:
解:A、20g重水(D2O)的物质的量是1mol,D2O分子中含有10个电子,含有的电子数为10NA,故A正确;
B、乙烯和环丙烷最简式相同为CH2,计算42gCH2中氢原子数=
×2×NA=6NA,故B正确;
C、氮气所处的状态不一定是标况,故22.4L氮气的物质的量不一定是1mol,故共用电子对数不一定是3NA,故C错误;
D、78gNa2O2的物质的量n=
=
=1mol,Na2O2由2个Na+和1个O22-构成,故1molNa2O2中含1mol阴离子,即NA个,故D正确;
故选C.
B、乙烯和环丙烷最简式相同为CH2,计算42gCH2中氢原子数=
| 42g |
| 14g/mol |
C、氮气所处的状态不一定是标况,故22.4L氮气的物质的量不一定是1mol,故共用电子对数不一定是3NA,故C错误;
D、78gNa2O2的物质的量n=
| m |
| M |
| 78g |
| 78g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,被氧化与被还原的氯原子的物质的量比为( )
| A、5:1 | B、1:5 |
| C、1:1 | D、3:1 |
下列溶液中的Cl-浓度与50mL 1.0mol?L-1 FeCl3溶液中的Cl-浓度相等的是( )
| A、100 mL 3.0 mol?L-1NaCl溶液 |
| B、75mL 1.0 mol?L-1CaCl2溶液 |
| C、150 mL 1.0mol?L-1KCl溶液 |
| D、100 mL 0.5 mol?L-1AlCl3溶液 |
设NA为阿伏加德罗常数,如果ag某气体含分子数为P,则bg该气体在标准状况下的体积V(L)是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列离子方程式书写正确的是( )
| A、Ba(OH)2溶液与过量的NaHCO3溶液混合:Ba2++OH-+HCO3-=BaCO3↓+H2O |
| B、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D、氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4L水的分子数为NA |
| B、常温下将23gNa投入到0.5L1.0mol?L-1的盐酸中反应共转移的电子数为0.5NA |
| C、0.5mol/LKCl溶液中含有0.5NA个K+ |
| D、12.0g熔融的NaHSO4中含有0.1NA个阳离子 |
下列物质中一定含有氢元素,不一定含有氧元素的是( )
①酸 ②酸式盐 ③碱 ④碱式盐 ⑤碱性氧化物.
①酸 ②酸式盐 ③碱 ④碱式盐 ⑤碱性氧化物.
| A、①② | B、①②③④ |
| C、②④ | D、①②④ |
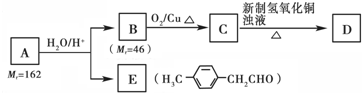
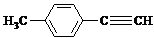 )的一条路线如下:
)的一条路线如下: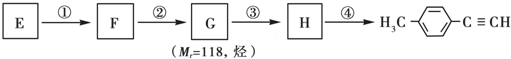

 ,写出草酰氯(结构式:
,写出草酰氯(结构式: )与足量有机物D反应的化学方程式:
)与足量有机物D反应的化学方程式: ,由邻甲基苯酚经过两步反应可生成有机物A:邻甲基苯酚→中间产物→有机物A,请写出“中间产物”的结构简式
,由邻甲基苯酚经过两步反应可生成有机物A:邻甲基苯酚→中间产物→有机物A,请写出“中间产物”的结构简式