题目内容
下列离子方程式书写正确的是( )
| A、AgNO3溶液中加入过量的氨水:Ag++NH3.H20═AgOH↓+NH+4 |
| B、向碳酸钡固体中加入足量NaHSO4溶液:BaCO3+SO42-═BaSO4+CO32- |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++Cl2═3Fe3++2Cl- |
| D、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=BaCO3↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.加入过量的氨水,生成银氨溶液;
B.反应生成硫酸钡、水和气体;
C.亚铁离子、溴离子均被氧化;
D.小苏打完全反应,反应生成碳酸钙和水、NaOH.
B.反应生成硫酸钡、水和气体;
C.亚铁离子、溴离子均被氧化;
D.小苏打完全反应,反应生成碳酸钙和水、NaOH.
解答:
解:A.AgNO3溶液中加入过量的氨水:Ag++2NH3.H20═[Ag(NH3)2]++OH-+H20,故A错误;
B.向碳酸钡固体中加入足量NaHSO4溶液的离子反应为2H++BaCO3+SO42-═BaSO4↓+CO2↑+H20,故B错误;
C.溴化亚铁溶液中通入足量氯气的离子反应为4Br-+2Fe2++3Cl2═2Fe3++6Cl-,+2Br2,故C错误;
D.澄清石灰水与少量小苏打溶液混合的离子反应为Ca2++OH-+HCO3-=BaCO3↓+H2O,故D正确;
故选D.
B.向碳酸钡固体中加入足量NaHSO4溶液的离子反应为2H++BaCO3+SO42-═BaSO4↓+CO2↑+H20,故B错误;
C.溴化亚铁溶液中通入足量氯气的离子反应为4Br-+2Fe2++3Cl2═2Fe3++6Cl-,+2Br2,故C错误;
D.澄清石灰水与少量小苏打溶液混合的离子反应为Ca2++OH-+HCO3-=BaCO3↓+H2O,故D正确;
故选D.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的考查,题目难度不大.

练习册系列答案
相关题目
下列四种物质“水解”时,其反应物和产物之间化合价发生明显变化的是( )
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、PCl3的水解产物是PH3和HClO |
| C、Mg3N2的水解产物是Mg(OH)2和NH3 |
| D、SiCl4的水解产物是H4SiO4与HCl |
下列说法正确的是( )
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
下列化学用语表达正确的是( )
A、硝基苯的结构简式: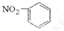 | ||
B、NH4Cl的电子式: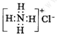 | ||
C、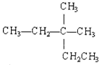 的名称为:3,3二甲基戍烷 的名称为:3,3二甲基戍烷 | ||
D、具有16个质子、16个种子和18个电子的微粒一定是
|
 A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.
A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用. 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.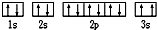 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了
