题目内容
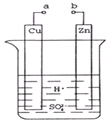
下列叙述是某同学做完铜锌原电池实验后得出的结论和认识,正确的是( )
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C、电流通过硫酸溶液,SO42-向正极移动 |
| D、铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.构成原电池正负极的材料不一定都是金属;
B.原电池中,易失电子的金属作负极;
C.原电池放电时,阴离子向负极移动;
D.根据锌和转移电子之间的关系式计算.
B.原电池中,易失电子的金属作负极;
C.原电池放电时,阴离子向负极移动;
D.根据锌和转移电子之间的关系式计算.
解答:
解:A.构成原电池正负极的材料不一定都是金属,如锌、石墨和稀硫酸也能构成原电池,故A错误;
B.原电池中,易失电子的金属作负极,所以由铜锌作为电极与硫酸铜溶液组成的原电池中,Zn是负极,故B错误;
C.原电池放电时,阴离子向负极移动,所以硫酸根离子向负极移动,故C错误;
D.负极电极反应为Zn-2e-=Zn2+,根据锌和转移电子关系得转移电子的物质的量=
×2=0.4mol,故D正确;
故选D.
B.原电池中,易失电子的金属作负极,所以由铜锌作为电极与硫酸铜溶液组成的原电池中,Zn是负极,故B错误;
C.原电池放电时,阴离子向负极移动,所以硫酸根离子向负极移动,故C错误;
D.负极电极反应为Zn-2e-=Zn2+,根据锌和转移电子关系得转移电子的物质的量=
| 13g |
| 65g/mol |
故选D.
点评:本题考查了原电池原理,根据得失电子判断正负极,知道原电池构成条件及各个物理量之间的关系即可解答,注意电解质溶液中阴阳离子移动方向,为易错点.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
把一小块钠放入下列溶液中,既能产生气体又会出现沉淀的是( )
| A、稀H2S04 |
| B、KOH稀溶液 |
| C、氯化铁溶液 |
| D、氯化钠溶液 |
有关化学用语正确的是( )
A、-CH3(甲基)的电子式为 |
B、硝基苯的结构简式 |
| C、乙烯的结构简式CH2CH2 |
| D、乙酸的分子式C2H4O2 |
 浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2 | 充电 |
| 放电 |
| A、电池的电解液可为LiCl水溶液 |
| B、该电池放电时,负极发生还原反应 |
| C、充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 |
| D、放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
下列反应中前者属于取代反应,后者属于加成反应的是( )
| A、在苯中滴入溴水,溴水褪色;乙烯生成聚乙烯的反应 |
| B、甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色 |
| C、乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 |
| D、苯滴入浓硝酸和浓硫酸的混合液中,有油状生成;乙烯与水生成乙醇的反应 |
 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献. 