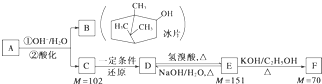
题目内容
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).已知:室温下①2NO+Na2O2→2NaNO2②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
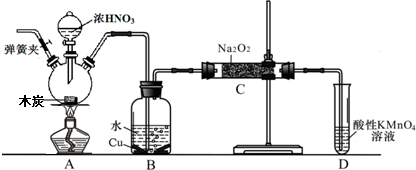
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 .
(2)B中观察到的主要现象是 ,D装置的作用是 .
(3)检验C中产物有亚硝酸钠的方法是 .
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和 ,为避免产生这些副产物应在B、C装置间增加装置E,画出E并注明E中盛放的药品名称 .
(5)写出检验C产物中是否含碳酸钠的方法 .
(6)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g.

完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式
(2)B中观察到的主要现象是
(3)检验C中产物有亚硝酸钠的方法是
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和
(5)写出检验C产物中是否含碳酸钠的方法
(6)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭
考点:制备实验方案的设计
专题:实验题
分析:(1)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,依据氧化还原反应电子守恒和原子守恒配平;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(3)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
(5)依据碳酸钠与强酸反应生成能使澄清石灰水变浑浊的气体证明产物中是否是碳酸钠;
(6)根据①C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算.
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(3)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
(5)依据碳酸钠与强酸反应生成能使澄清石灰水变浑浊的气体证明产物中是否是碳酸钠;
(6)根据①C+4HNO3(浓)
| ||
解答:
解:(1)装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
故答案为:氢氧化钠;干燥管 碱石灰;
(5)检验碳酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,则产物有碳酸钠.
故答案为:取样,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,则产物有碳酸钠;
(6)根据①C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,
②3NO2+H2O=2HNO3+NO;
③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
④2NO+Na2O2═2NaNO2,
则有C~4NO2~
NO
4NO2~
HNO3~
NO
C~(
+
)=2NO~Na2O2~2NaNO2,
所以1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭的质量为
×12g/mol=0.24g,故答案为:0.24.
| ||
故答案为:C+4HNO3(浓)
| ||
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
故答案为:氢氧化钠;干燥管 碱石灰;
(5)检验碳酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,则产物有碳酸钠.
故答案为:取样,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,则产物有碳酸钠;
(6)根据①C+4HNO3(浓)
| ||
②3NO2+H2O=2HNO3+NO;
③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
④2NO+Na2O2═2NaNO2,
则有C~4NO2~
| 4 |
| 3 |
4NO2~
| 8 |
| 3 |
| 2 |
| 3 |
C~(
| 4 |
| 3 |
| 2 |
| 3 |
所以1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭的质量为
| 1.56g |
| 78g/mol |
点评:本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列物质中,体积为22.4升的是( )
| A、20℃时18g水 |
| B、标准状况下含6.02×1023个原子的Cl2 |
| C、常温常压下1mol氨 |
| D、标准状况下44g二氧化碳 |
下列说法正确的是( )
A、
| ||||||||
| B、1 mol CH4与1 mol NH4+所含质子数相等 | ||||||||
| C、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 | ||||||||
| D、二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 |
下列实验操作正确的是( )
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌漏斗中的液体 |
| B、分液操作中,将下层液体放入一烧杯后,再将上层液体继续放入另一烧杯中 |
| C、蒸发KNO3溶液时,当蒸发皿中出现大量晶体时即停止加热,用余热蒸干剩余的水分,获取KNO3晶体 |
| D、蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶壁 |
下列分离和提纯的实验操作中,正确的是( )


| A、蒸发 | B、过滤 | C、蒸馏 | D、分液 |