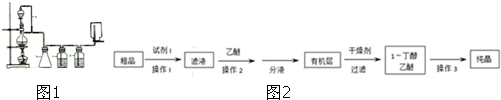
题目内容
向V1mL BaCl2溶液中加入V2mL 0.05mol?L-1的H2SO4,两者恰好完全反应,测得反应后溶液的pH为2.0(溶液体积的变化忽略不计),则原BaCl2的物质的量浓度为( )
| A、5.05×10-4mol?L-1 |
| B、5.56×10-3mol?L-1 |
| C、1.01×10-4mol?L-1 |
| D、1.01×10-3mol?L-1 |
考点:物质的量浓度的相关计算
专题:计算题
分析:0.05mol/L硫酸溶液中c(H+)=0.1mol/L,硫酸与氯化钡发生反应Ba2++SO42-=BaSO4↓,反应后溶液的pH为2.0,则c(H+)=1×10-2mol/L,说明反应后硫酸体积为原溶液体积的10倍,则应有V1=9V2,以此解答该题.
解答:
解:设BaCl2的物质的量浓度为xmol/L,
向V1mL BaCl2溶液中加入V2mL 0.05mol?L-1的H2SO4,反应Ba2++SO42-=BaSO4↓,
则V1x=0.05mol?L-1×V2,
反应后溶液的pH为2.0,则c(H+)=1×10-2mol/L,说明反应后硫酸体积为原溶液体积的10倍,则应有V1=9V2,
则x=
=
mol/L=5.56×10-3mol?L-1,
故选B.
向V1mL BaCl2溶液中加入V2mL 0.05mol?L-1的H2SO4,反应Ba2++SO42-=BaSO4↓,
则V1x=0.05mol?L-1×V2,
反应后溶液的pH为2.0,则c(H+)=1×10-2mol/L,说明反应后硫酸体积为原溶液体积的10倍,则应有V1=9V2,
则x=
| 0.05V2 |
| V1 |
| 0.05 |
| 9 |
故选B.
点评:本题考查物质的量浓度有关计算、离子方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,比较基础,注意基础知识的积累掌握.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
下列关于有机物的认识正确的是( )
| A、C2H6与氯气发生取代反应、C2H4与HCl发生加成反应均可得到纯净的C2H5Cl |
| B、将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 |
| C、乙烯结构中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应 |
| D、苯使酸性KMn04溶液、溴水都褪色,发生的都是氧化反应 |
关于溶液中所含离子的检验,下列判断正确的是( )
| A、向溶液中加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不溶解,则原溶液中一定含有SO42- |
| B、向溶液中滴加浓NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试液变红,则原溶液中一定含有NH4+ |
| C、向溶液中加入几滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制氯水,溶液变为血红色,该溶液中一定含有Fe2+ |
| D、向溶液中滴加稀盐酸产生无色无味气体,产生的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
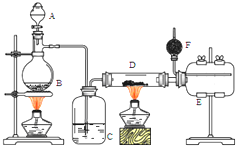 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
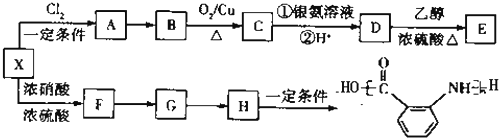

 )为原料合成对氨基苯甲酸乙酯(
)为原料合成对氨基苯甲酸乙酯( )的合成路线(试剂任选,用合成路线流程图表示)
)的合成路线(试剂任选,用合成路线流程图表示)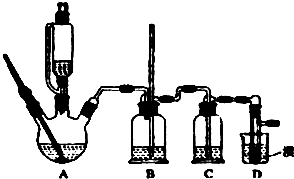 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH