题目内容
【题目】下列指定反应的离子方程式正确的是( )
A.少量的SO2通入到Ca(ClO)2溶液中:Ca(ClO)2 + SO2 + H2O ═ CaSO3↓+ 2HClO
B.室温下,测得氯化铵溶液pH<7,因为NH4+ + 2H2O NH3·H2O + H3O+
C.吸氧腐蚀负极的电极反应式为:Fe - 3e- ═ Fe3+
D.用碳酸氢钠溶液检验水杨酸中的羧基: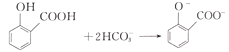
【答案】B
【解析】
A. 少量的SO2通入到Ca(ClO)2溶液中发生氧化还原反应生成硫酸钙、氯化钙,A错误;
B. 室温下,测得氯化铵溶液pH<7,这是由于铵根水解:NH4++2H2O![]() NH3·H2O+H3O+,B正确;
NH3·H2O+H3O+,B正确;
C. 吸氧腐蚀负极的电极反应式为:Fe-2e-=Fe2+,C错误;
D. 酚羟基与碳酸氢钠不反应,只有羧基与碳酸氢钠反应生成羧酸钠、二氧化碳和水,D错误;
答案选B。

【题目】现有三种常见元素的性质或结构如下表:
X | 与Al同周期,金属性最强 |
Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
W | 单质紫黑色,遇淀粉溶液显蓝色 |
(1)X元素的名称是___;Y的原子结构示意图是___;W在元素周期表中的位置是___;
(2)请写出Z的单质与X元素最高价氧化物所对应水化物的溶液在常温下反应的离子方程式___;
(3)判断非金属性Z___Y(填“>”或“<”),请用离子方程式进行说明:___。
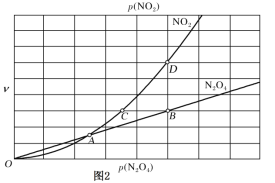
【题目】氮的氧化物(如NO2、N2O4、N2O5等)应用很广,在一定条件下可以相互转化。
(1)已知:N2O5在一定条件下发生分解2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
T/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol·L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(2)在N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
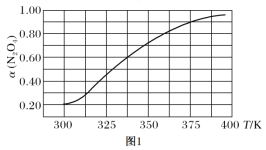
①337.5 K时,反应的平衡常数K=________(填写计算结果)。
②据图推测N2O4(g) ![]() 2NO2(g)是吸热反应,理由是_______________。
2NO2(g)是吸热反应,理由是_______________。
③对于反应N2O4(g)![]() 2NO2(g),用平衡时各组分压强关系表达的平衡常数
2NO2(g),用平衡时各组分压强关系表达的平衡常数![]() 。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。