题目内容
【题目】钴(Co)的氧化物是一种重要的化工原料,工业上利用反应CoCO3+O2![]() CoxOy+CO2来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
CoxOy+CO2来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
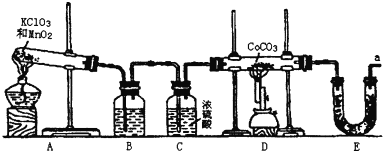
请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式___;
(2)E装置的U形管里盛放的物质是___;
A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是___;
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCl溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起___;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为___;请写出详细的计算过程。
(6)此实验装置存在一个比较大的缺陷,如何完善___。
【答案】2KClO3![]() 2KCl+3O2↑ C D 倒吸 Co2O3 在a处接一装有碱石灰的干燥管
2KCl+3O2↑ C D 倒吸 Co2O3 在a处接一装有碱石灰的干燥管
【解析】
根据实验装置分析可知,装置A为KClO3和MnO2共热制取氧气的装置,装置B为洗气装置,C装置中盛有浓硫酸,可干燥O2,D装置为制取钴的氧化物的装置,E装置用于吸收D装置中产生的CO2,据此分析解答问题。
(1)由上述分析知,装置A为KClO3和MnO2共热,MnO2作催化剂制取氧气的装置,发生的反应为2KClO3![]() 2KCl+3O2↑,故答案为:2KClO3
2KCl+3O2↑,故答案为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)E装置用于吸收D装置中产生的CO2,可选用碱石灰进行吸收,故答案为:C;
(3)已知制得的O2中含有少量的Cl2和O3,O3的氧化性比O2强,则
A.NaOH可以吸收Cl2但不能吸收O3,A不选;
B.饱和NaHCO3溶液可吸收Cl2,但会生成CO2影响实验结果,B不选;
C.饱和的NaCl溶液不能吸收Cl2,C不选;
D.可用KI溶液吸收Cl2和O3,D选项正确;
故答案为:D;
(4)实验结束时,若先撤去装置中的酒精灯,会导致装置A中的压强降低,发生倒吸,故答案为:倒吸;
(5)E管增重4.40g是二氧化碳的质量,物质的量为0.1mol,根据化学式CoCO3可知,n(Co)=n(C)=0.1mol,则Co的质量为0.1mol×59g/mol=5.9g,D管内残留物质的质量8.30g是CoxOy的质量,CoxOy中氧元素质量为8.3g-5.9g=2.4g,则氧原子的物质的量n(O)=2.4g÷16g/mol=0.15mol,所以n(Co):n(O)=2:3,该氧化物的化学式为Co2O3,故答案为:Co2O3;
(6)装置E中碱石灰可以吸收空气中的水蒸气和二氧化碳,会影响二氧化碳质量的测定,应该在a处接一装有碱石灰的干燥管,吸收空气中的水蒸气和二氧化碳,故答案为:在a处接一装有碱石灰的干燥管。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案