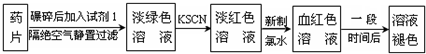
题目内容
将适量的MO2粉末投入热水中,一边搅拌,一边通入SO2气体,结果得到白色不溶物X,已知X既是氧化产物又是还原产物.下列判断错误的是( )
①MO2具有氧化性②白色不溶物X为MSO2③白色不溶物X为MSO4④白色不溶物X为MS.
①MO2具有氧化性②白色不溶物X为MSO2③白色不溶物X为MSO4④白色不溶物X为MS.
| A、①② | B、③④ | C、②④ | D、①③ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:白色不溶物X应为硫酸盐,X既是氧化产物又是还原产物,反应中S元素的化合价升高,M元素的化合价降低,以此来解答.
解答:
解:白色不溶物X应为硫酸盐,X既是氧化产物又是还原产物,反应中S元素的化合价升高,则二氧化硫具有还原性,M元素的化合价降低,具有MO2具有氧化性,显然①③正确,故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析应用能力的考查,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列物质中,可以作为食品防腐剂的是( )
| A、碳酸氢钠 | B、L-谷氨酸钠 |
| C、苯甲酸钠 | D、乳酸 |
在给定的溶液中,加入对应的一组离子,则该组离子能在原溶液中大量共存的是( )
| A、滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3- |
| B、含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- |
| C、常温下由水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D、含有溶质为NaHSO4的溶液:K+、SiO32-、NO3-、Al3+ |
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
| 放电 |
| 充电 |
| A、可加入硫酸以提高电解质的导电性 |
| B、放电时电池内部Li+向负极移动. |
| C、充电过程中,电池正极材料的质量不变 |
| D、放电时电池正极反应为:FePO4+Li++e-=LiFePO4 |
将a、b、c、d 4种金属两两连接浸入电解质溶液中,组成4个原电池(如图):
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )
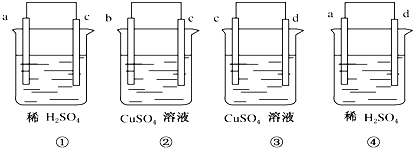
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )

| A、d>a>c>b |
| B、b>d>c>a |
| C、d>c>a>b |
| D、a>d>b>c |
下列物质中,含有自由移动的Cl-的是( )
| A、KClO3溶液 |
| B、CaCl2溶液 |
| C、KCl晶体 |
| D、液态HCl |
 3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )
3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )| A、图中C表示生成物NH3(g)的总能量 |
| B、断裂3molH-H和1mol N≡N所吸收的总能量大于形成6mol N-H所释放的总能量 |
| C、逆反应的活化能E(逆)=E+△H |
| D、3 H2(g)+N2(g)?2NH3(g)△H<0 |