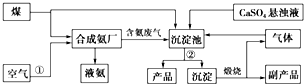
题目内容
2.下列各组混合物中,能用分液漏斗进行分离的是( )| A. | 水和CCl4 | B. | 液溴和CCl4 | C. | 酒精和水 | D. | 汽油和菜籽油 |
分析 能用分液漏斗进行分离的物质应互不相溶,结合常见物质的水溶性解答该题.
解答 解:液溴和CCl4、酒精和水、汽油和菜籽油都混溶,溶液不分层,而水和四氯化碳分层,可用分液的方法分离,
故选A.
点评 本题考查有机物的水溶性,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意常见有机物的性质,特别是水溶性的特点.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
13.硝基苯酚是合成医药、染料、感光材料的中间体;以苯酚为原料制备硝基苯酚的步骤如下:
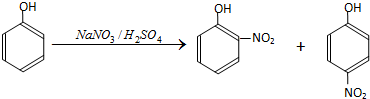
I.在常温下,向250mL三口烧瓶中加试剂(加入的试剂有:
A.50mL水;B.17.5gNaNO3;C.15mL浓硫酸
Ⅱ.称取4.7g苯酚,与1mL温水混合,并冷却至室温.
Ⅲ.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在20℃左右.
Ⅳ.加完苯酚后,继续搅拌1h,冷却至黑色油状物固化,倾出酸层.然后向油状物中加入20mL水并振摇,先倾出洗液,再用水洗三次,以除净残存的酸..
V.邻硝基苯酚的提纯.固化的黑色油状物主要成分是邻硝基苯酚和对硝基苯酚.
(1)步骤I中加入试剂的先后顺序为ACB(填序号)
(2)苯酚有腐蚀性,步骤Ⅱ中若不慎使苯酚触及皮肤,应立刻用酒精棉擦洗.苯酚中加少许水可降低熔点,使其中室温下即呈液态,这样操作的作用是便于滴加,同时也可以加快反应.
(3)步骤Ⅲ中,将反应温度维持在20℃左右的原因是当温度过高,一元硝基酚有可能发生进步硝化,当温度偏低,又将减缓反应速度.
(4)步骤Ⅳ中,若黑色油状物未固化,则可用分液漏斗(填实验仪器)将黑色油状物分出.
(5)根据题给信息,不使用温度计,设计步骤V得到纯净的邻硝基苯酚的实验方案;对油状混合物作水蒸气蒸馏,将馏出液冷却过滤,收集晶体,即得邻硝基苯酚产物.

I.在常温下,向250mL三口烧瓶中加试剂(加入的试剂有:
A.50mL水;B.17.5gNaNO3;C.15mL浓硫酸
Ⅱ.称取4.7g苯酚,与1mL温水混合,并冷却至室温.
Ⅲ.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在20℃左右.
Ⅳ.加完苯酚后,继续搅拌1h,冷却至黑色油状物固化,倾出酸层.然后向油状物中加入20mL水并振摇,先倾出洗液,再用水洗三次,以除净残存的酸..
V.邻硝基苯酚的提纯.固化的黑色油状物主要成分是邻硝基苯酚和对硝基苯酚.
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | 其他 | |
| 邻硝基苯酚 | 1.495 | 44.45 | 214 | 微溶于冷水,易溶于热水 | 能与水蒸气一同挥发 |
| 对硝基苯酚 | 11.481 | 113.4 | 279 | 稍溶于水 | 不与水蒸气一同挥发 |
(2)苯酚有腐蚀性,步骤Ⅱ中若不慎使苯酚触及皮肤,应立刻用酒精棉擦洗.苯酚中加少许水可降低熔点,使其中室温下即呈液态,这样操作的作用是便于滴加,同时也可以加快反应.
(3)步骤Ⅲ中,将反应温度维持在20℃左右的原因是当温度过高,一元硝基酚有可能发生进步硝化,当温度偏低,又将减缓反应速度.
(4)步骤Ⅳ中,若黑色油状物未固化,则可用分液漏斗(填实验仪器)将黑色油状物分出.
(5)根据题给信息,不使用温度计,设计步骤V得到纯净的邻硝基苯酚的实验方案;对油状混合物作水蒸气蒸馏,将馏出液冷却过滤,收集晶体,即得邻硝基苯酚产物.
17.下列事故处理不正确的是( )
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |
7.除去括号内杂质所用试剂和方法不正确的是( )
| A. | Cu(Fe)----加盐酸,过滤 | B. | NaCl溶液(碘)----CCl4,萃取、分液 | ||
| C. | KCl溶液(KNO3)----降温结晶,过滤 | D. | Cl2(HCl)----饱和氯化钠溶液,洗气 |
14.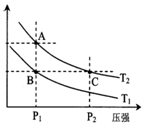 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
11.将NO2装入带有活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
| A. | 升高温度,气体颜色加深,则此反应为吸热反应 | |
| B. | 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅 | |
| C. | 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 | |
| D. | 恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅 |
12.某工厂排出的废液中含有Ba2+、Ag+、Cu2+,用①Na2SO4溶液,②NaOH溶液,③盐酸三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是( )
| A. | ③①② | B. | ②①③ | C. | ①②③ | D. | ②③① |