题目内容
15.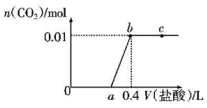 向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )
向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )| A. | a点时溶液中存在c(Na+)=c(HCO3-)+C(CO32-)+c(H2CO3) | |
| B. | 0~a段溶液中水电离出的OH-浓度先增大后减小 | |
| C. | a=0.2 | |
| D. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2↑ |
分析 向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,NaOH+HCl=NaCl+H2O,继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,a点溶质为NaCl、NaHCO3,继续滴加时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,此时开始放出气体,以此来解答.
解答 解:A.a点溶质为NaCl、NaHCO3,则c(Na+)>c(HCO3-)+C(CO32-)+c(H2CO3),故A错误;
B.0~a段,先发生NaOH+HCl=NaCl+H2O,碱性降低,水电离出的OH-浓度增大,后发生HCl+Na2CO3=NaHCO3+NaCl,水解程度减小,则水电离OH-浓度减小,故B正确;
C.根据碳元素守恒,混合物中,碳酸钠的物质的量是0.01mol,所以两步反应:HCl+Na2CO3=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,分别消耗的盐酸的量是0.01mol,0.1mol•L-1稀盐酸的体积分别是0.1L,所以a=0.3,故C错误;
D.ab段发生反应为NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为HCO3-+H+=H2O+CO2↑,故D错误;
故选B.
点评 本题考查离子浓度比较及化学反应的计算,为高频考点,把握图象与反应的对应关系为解答的关键,侧重分析与计算能力的考查,注意a点溶质为NaCl、NaHCO3,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
5.进入秋冬季节后,雾霾这种环境污染问题逐渐凸显.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 胶粒可以导电 | B. | 胶体有丁达尔效应 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
3.W、X、Y、Z分别为原子序数递增的短周期元素,X、Y的阳离子与Ne具有相同的电子层结构,且其单质均可与水反应,生成W的单质;Z的单质为黄绿色气体.下列说法正确的是( )
| A. | W与X形成的简单二元化合物的电子式为 | |
| B. | 短周期元素中Y的原子半径最大 | |
| C. | 工业上通过电解Y的氧化物制取Y的单质 | |
| D. | 最外层电子数等于其电子层数的金属与Z形成离子化合物 |
10.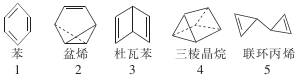 在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
 在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )| A. | 1~5对应的结构均能与氢气在一定条件下发生加成反应 | |
| B. | 1~5对应的结构中的一氯取代物只有1种的有3个 | |
| C. | 1~5对应的结构中所有原子均可能处于同一平面的有1个 | |
| D. | 1~5对应的结构中能使溴的四氯化碳溶液褪色的有4个 |
20.下列各原子或离子的电子排布式错误的是( )
| A. | K+ 1s22s22p63s23p6 | B. | F 1s22s22p5 | ||
| C. | S2- 1s22s22p63s23p4 | D. | Ar 1s22s22p63s23p6 |
7.下列各组物质,一定是同系物的是( )
| A. | 分子式为C4H6和C5H8的烃 | B. | 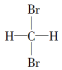 和 和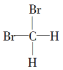 | ||
| C. | 符合CnH2n通式的烃 | D. | 分子式为C4H10和C20H42的烃 |
4.下列说法正确的是( )
| A. | BaCl2溶液中通入足量的SO2气体后,所得溶液中2c(Ba2+)═c(Cl-) | |
| B. | 某溶液由水电离的c(H+)=1×10-amol/L,若a>7,则该溶液的pH一定为14-a | |
| C. | 物质的量浓度相等的H2S和NaHS混合溶液:c(Na+)═2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 常温下,若0.1mol/L NaHY溶液的pH=4,则该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H2Y)>c(Y2-) |
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 过量的SO2通入NaOH溶液中:SO2-+2OH-=SO32-+H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
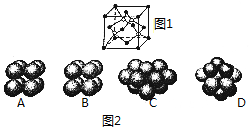 (1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同
(1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同