题目内容
20.(1)氯气是一种重要的化工原料,也是一种常用的消毒剂.①实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②某同学将 8.7g 二氧化锰与 50ml12mol•L-1 浓盐酸在圆底烧瓶中共热,直到反应停止,最后发 现烧瓶中还有固体剩余,该同学还检测到有一定量的盐酸剩余,为什么盐酸和二氧化锰均有剩余?二氧化锰和稀盐酸之间不会发生反应;
(2)工业上常用氯气生产漂白粉,请写出反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,在空气中漂白粉长期存放会变质而失效的原理是Ca(ClO)2+CO2+H2O=CaCO3+2HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑(用化学方程式说明)
(3)新制氯水存在的各种粒子中:(用化学式或离子符号填写)
①使氯水呈黄绿色的是Cl2;
②能使紫色石蕊试液显红色的是H+;
③能使湿润的红纸褪色的是HClO.
分析 (1)①二氧化锰和浓盐酸反应生成氯化锰、氯气、水;
②二氧化锰和稀盐酸之间不会发生反应;
(2)工业上制备漂白粉是利用石灰乳和氯气反应生成氯化钙、次氯酸钙和水,漂白粉成分为氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙;漂白粉长期暴露在空气中会逐渐失效,是因为次氯酸钙和空气中的二氧化碳、水反应生成碳酸钙沉淀和次氯酸,次氯酸见光分解生成氧气和盐酸;
(3)氯气溶于水,在水中发生Cl2+H2O?H++Cl-+HClO,HClO为若电解质,则溶液中存在的分子有H2O、Cl2、HClO等,存在的离子有:H+、Cl-、OH-、ClO-等,根据微粒的性质来回答.
解答 解:(1)①实验室通常用二氧化锰和浓盐酸反应制取氯气的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②将 8.7g 二氧化锰与 50ml12mol•L-1 浓盐酸在圆底烧瓶中共热,直到反应停止,最后发 现烧瓶中还有固体剩余,有一定量的盐酸剩余,是因为:二氧化锰和稀盐酸之间不会发生反应;故答案为:二氧化锰和稀盐酸之间不会发生反应;
(2)工业上制备漂白粉是利用石灰乳和氯气反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉成分为氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙,漂白粉长期暴露在空气中会逐渐失效,是因为次氯酸钙和空气中的二氧化碳、水反应生成碳酸钙沉淀和次氯酸,Ca(ClO)2+CO2+H2O=CaCO3+2HClO,次氯酸见光分解生成氧气和盐酸,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3+2HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(3)①使氯水呈黄绿色的是Cl2,故答案为:Cl2;
②能使紫色石蕊试液显红色的是H+,故答案为:H+;
③能使湿润的红纸褪色的是HClO,故答案为:HClO;
点评 本题考查氯水成分,题目难度不大,本题注意把握氯气与水反应的性质以及次氯酸的性质.

 名校课堂系列答案
名校课堂系列答案| A. | 1H、2H、3H互为同素异形体 | |
| B. | CO2的比例模型: | |
| C. | NaHCO3在水溶液中的电离方程式:NaHCO3?Na++HCO3-HCO3-?H++CO32- | |
| D. | 次氯酸的电子式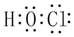 |
| A. | CuCl2溶液蒸干灼烧后得到CuCl2固体 | |
| B. | 火力发电的目的是使化学能转换为电能 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性. | |
| D. | 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液 |
| A. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| B. | 分液操作时,静置分层后要先放出分液漏斗中下层液体,再倒出上层液体 | |
| C. | 分液操作时,选择的萃取剂的密度必须比水大 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端靠在试管内壁 |
(1)将相关的含硫物质分为如下表所示3组.第3组中物质X的化学式是H2SO4.
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO4、Na2SO3、NaHSO3 | SO3、X、Na2SO4、NaHSO4 |
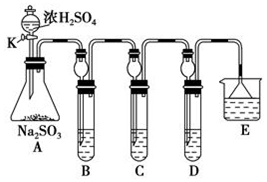
①在B中检验SO2的氧化性,则B中发生的化学反应方程式:SO2+2H2S=3S↓+2H2O.
②在C中装KMnO4溶液,目的是检验SO2的还原性,溶液逐渐褪色.生成Mn2+.同时pH降低.则C中反应的离子方程式为5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+.
③在D中有40mL2.5mol/LNaOH溶液,反应后增重4,则装置D中发生反应的总化学方程式是5SO2+8NaOH=3Na2SO3+2NaHSO3+3H2O.
| A. | 铜来源广泛,易于从自然界冶炼得到 | |
| B. | 铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型 | |
| C. | 铜的外观为紫红色,大方美观,易于被人们接受 | |
| D. | 铜的化学性质不稳定,在空气中易转化为铜绿,铜绿具有抗腐蚀能力,易于流通 |
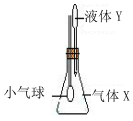 在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( )
在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( ) ,COS属于极性分子(填“极性”或“非极性”).
,COS属于极性分子(填“极性”或“非极性”).