题目内容
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A、所得溶液中的c (H+)=10-13mol/L |
| B、所得溶液中由水电离产生的c (OH-)=10-13 mol/L |
| C、所加的烧碱溶液的pH=13.0 |
| D、所得溶液中的c (Mg2+)=5.6×10-10 mol/L |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A.根据pH=-lg[c (H+)]计算;
B.溶液中由水电离产生的c(OH-)水=c (H+)水=10-PHmol?L-1;
C.根据烧碱与MgCl2溶液反应生成沉淀,消耗了NaOH溶液;
D.根据溶度积公式c(Mg2+)=
计算.
B.溶液中由水电离产生的c(OH-)水=c (H+)水=10-PHmol?L-1;
C.根据烧碱与MgCl2溶液反应生成沉淀,消耗了NaOH溶液;
D.根据溶度积公式c(Mg2+)=
| Ksp |
| c2(OH-) |
解答:
解:A.pH=13的溶液中,c (H+)=10-13mol/L,故A正确;
B.由水电离产生的c(OH-)水=c (H+)水=10-PHmol?L-1=10-13mol/L,故B正确;
C.因为向MgCl2溶液中加NaOH溶液后混合溶液的pH=13,所以所加NaOH溶液pH>13,故C错误;
D.Mg(OH)2的溶度积常数Ksp=5.6×10-12,溶液中的c(Mg2+)=
=
=5.6×10-10mol/L,故D正确.
故选C.
B.由水电离产生的c(OH-)水=c (H+)水=10-PHmol?L-1=10-13mol/L,故B正确;
C.因为向MgCl2溶液中加NaOH溶液后混合溶液的pH=13,所以所加NaOH溶液pH>13,故C错误;
D.Mg(OH)2的溶度积常数Ksp=5.6×10-12,溶液中的c(Mg2+)=
| Ksp |
| c2(OH-) |
| 5.6×10-12 |
| (10-1)2 |
故选C.
点评:本题考查平衡常数及沉淀的生成,注意溶度积常数的利用,把握影响pH与浓度的关系、水的电离等即可解答,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
给CH3COOH、C2H518OH和浓硫酸的混合物加热,一段时间后,18O存在于( )
| A、只存在乙酸分子中 |
| B、存在于乙酸乙酯、乙醇中 |
| C、只存在于乙醇分子中 |
| D、只存在于水分子中 |
下列有关实验操作或装置正确的是( )


| A、用图1所示装置进行乙酸乙酯水解 |
| B、用图2所示装置实验室制取乙烯 |
| C、碘水用CCl4萃取分液后再蒸馏,可得到I2 |
| D、梨形分液漏斗检漏,加水后玻璃旋塞处是否漏水即可 |
 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.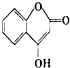 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: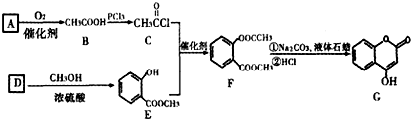
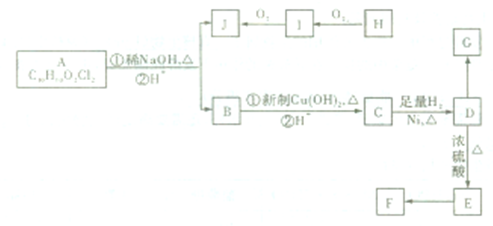
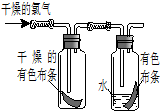 (1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是