题目内容
给CH3COOH、C2H518OH和浓硫酸的混合物加热,一段时间后,18O存在于( )
| A、只存在乙酸分子中 |
| B、存在于乙酸乙酯、乙醇中 |
| C、只存在于乙醇分子中 |
| D、只存在于水分子中 |
考点:乙酸乙酯的制取
专题:有机反应
分析:羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢.
解答:
解:乙酸与乙醇反应乙酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以乙酸与乙醇反应方程式为CH3COOH+CH3CH218OH
CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中.
故选B.
| 浓硫酸 |
| △ |
故选B.
点评:本题考查酯化反应的原理与特点,难度不大,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
 关于下列各图的叙述不正确的是( )
关于下列各图的叙述不正确的是( )| 表 丙 | |
| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2=2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.045mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表丙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是( )
| A、单质都是由同种元素组成的,只含一种元素的物质一定是纯净物 |
| B、金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气 |
| C、中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 |
| D、氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物 |
化学与生活密切相关.下列说法中不正确的是( )
| A、塑料、橡胶、纤维都是有机高分子化合物 |
| B、核电站泄露的放射性物质131I和127I互为同位素,化学性质相似 |
| C、以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D、氢氧化铁胶体、含PM2.5(是指大气中直径接近于2.5×10-5m的细颗粒物)的大气均具有丁达尔效应 |
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A、所得溶液中的c (H+)=10-13mol/L |
| B、所得溶液中由水电离产生的c (OH-)=10-13 mol/L |
| C、所加的烧碱溶液的pH=13.0 |
| D、所得溶液中的c (Mg2+)=5.6×10-10 mol/L |

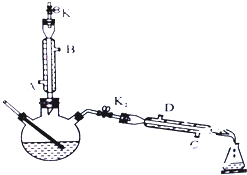 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题