题目内容
决定物质性质的重要因素是物质结构.请回答下列问题:
(1)铜是过渡元素.化合物中,铜常呈现+1价或+2价.如图为某铜氧化物晶体结构单元,该氧化物的化学式为 .

(2)第三周期部分元素氟化物的熔点见如表:
解释MgF2与SiF4熔点差异的原因 .
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
则A的电负性 B的电负性(填“>”、“<”或“=”).
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是 (填化学式).
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4).

(1)铜是过渡元素.化合物中,铜常呈现+1价或+2价.如图为某铜氧化物晶体结构单元,该氧化物的化学式为

(2)第三周期部分元素氟化物的熔点见如表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4).
考点:元素电离能、电负性的含义及应用,配合物的成键情况
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)由晶体结构用均摊法,求出原子个数之比;
(2)分子晶体的熔沸低于离子晶体;
(3)周期表中,同周期元素从左到右电负性逐渐增强;
(4)根据钒离子、铬离子和铁离子与亚铁离子的未成对电子判断;
(5)②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,氧原子与氢原子之间形成氢键.
(2)分子晶体的熔沸低于离子晶体;
(3)周期表中,同周期元素从左到右电负性逐渐增强;
(4)根据钒离子、铬离子和铁离子与亚铁离子的未成对电子判断;
(5)②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,氧原子与氢原子之间形成氢键.
解答:
解:(1)由晶体结构用均摊法,铜与氧的原子个数之比4:(8×
+1)=2:1,所以化学式为:Cu2O,故答案为:Cu2O;
(2)分子晶体的熔沸低于离子晶体,MgF2为离子晶体,而SiF4为分子晶体,离子晶体熔沸点高于分子晶体,故答案为:MgF2为离子晶体,而SiF4为分子晶体,离子晶体熔沸点高于分子晶体;
(3)周期表中,同周期元素从左到右电负性逐渐增强,则A、B的电负性从大到小的顺序为Al、Mg,因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定,所以Mg的第一电离能大于Al.
故答案为:>;
(4)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6,无未成对电子,CrO2中铬离子的核外电子排布式为:1s22s22p63s23p63d2两对未成对电子,而Fe3O4中有14对未成对电子,以Fe3O4中的未成对电子数最多,故答案为:Fe3O4;
(5)②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示: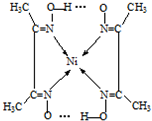 ,
,
故答案为: .
.
| 1 |
| 8 |
(2)分子晶体的熔沸低于离子晶体,MgF2为离子晶体,而SiF4为分子晶体,离子晶体熔沸点高于分子晶体,故答案为:MgF2为离子晶体,而SiF4为分子晶体,离子晶体熔沸点高于分子晶体;
(3)周期表中,同周期元素从左到右电负性逐渐增强,则A、B的电负性从大到小的顺序为Al、Mg,因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定,所以Mg的第一电离能大于Al.
故答案为:>;
(4)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6,无未成对电子,CrO2中铬离子的核外电子排布式为:1s22s22p63s23p63d2两对未成对电子,而Fe3O4中有14对未成对电子,以Fe3O4中的未成对电子数最多,故答案为:Fe3O4;
(5)②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示:
 ,
,故答案为:
 .
.
点评:本题考查了晶体结构用均摊法,电负大小的比较,化学键、核外电子排布规律等,涉及的知识点较多,题目综合性较强,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是( )
①用98%的浓硫酸代替稀硫酸 ②加热 ③改用铝粉 ④增大稀硫酸的体积 ⑤加水 ⑥加入少量硫酸铜.
①用98%的浓硫酸代替稀硫酸 ②加热 ③改用铝粉 ④增大稀硫酸的体积 ⑤加水 ⑥加入少量硫酸铜.
| A、全部 | B、②③⑥ |
| C、①②③⑥ | D、②③④⑥ |
下列各组物质中,化学键类型不同的是( )
| A、NaCl和CH4 |
| B、H2O和NH3 |
| C、CaF2和CsCl |
| D、NaOH和K2SO4 |
下列说法正确的是( )
| A、光导纤维的主要成分是硅 |
| B、常用氢氧化钠溶液来刻蚀玻璃 |
| C、制普通玻璃的主要原料是烧碱、石灰石、石英 |
| D、实验室用塑料瓶保存氢氟酸(HF) |