题目内容
14.实验测得常温下0.1mol/L某一元酸HA溶液的pH≠1,0.1mol/L某一元碱BOH溶液里$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12.将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )| A. | c (A-)>c (B+)>c (H+)>c (OH-) | B. | c (B+)=c (A-)>c (H+)=c (OH-) | ||
| C. | c (OH-)-c (H+)=c(HA) | D. | c (B+)+c (H+)=c (A-)+c (OH-)+c(HA) |
分析 常温下0.1mol/L某一元酸(HA)溶液的pH不等于l,说明HA没有完全电离,为弱酸,0.1mol/L某一元碱(BOH)溶液里$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱弱酸盐,溶液呈碱性,以此解答该题.
解答 解:常温下0.1mol/L某一元酸(HA)溶液的pH不等于l,说明HA没有完全电离,为弱酸,0.1mol/L某一元碱(BOH)溶液里$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱弱酸盐,溶液呈碱性,则c(OH-)>c(H+),
A.由于A-发生水解生成HA,则c(B+)>c(A-),盐的水解程度一般较弱,应有c(A-)>c(OH-),则c(B+)>c(A-)>c(OH-)>c(H+),故A错误;
B.依据A分析可知滤渣难度大小为:c(B+)>c(A-)>c(OH-)>c(H+),故B错误;
C.溶液中存在质子守恒,c (OH-)=c (H+)+c(HA),则c (OH-)-c (H+)=c(HA),故C正确;
D.溶液中存在电荷守恒c (B+)+c (H+)=c (A-)+c (OH-),故D错误;
故选C.
点评 本题考查离子浓度的大小比较,溶液中电荷守恒、质子守恒、物料守恒的分析判断,题目难度中等,解答该题的关键是根据溶液的pH和溶液中氢离子与氢氧根离子判断电解质的强弱,结合盐类水解的原理可解答该题.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
5.下列化学用语表示正确的是( )
| A. | S2-的结构示意图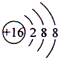 | B. | 乙酸的结构简式:C2H4O2 | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$CL | D. | 二氧化碳分子的比例模型是: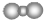 |
9.下列变化为放热反应的是( )


| A. | 2NH4Cl+Ba(OH)2•H2O═BaCl2+2NH3↑+10H2O | |
| B. | 2HI(g)═H2(g)+I2(g)△H=+14.9 kJ.mol-1 | |
| C. | 形成化学键时共放出能量862 kJ的化学反应 | |
| D. | 能量变化如图所示的化学反应 |
19.近年来,食品安全问题越来越引起社会的广泛关注,下列做法你认为合理的是( )
| A. | 在鸭子的饲料中添加苏丹红,可以产出蛋黄特红的红心鸭蛋 | |
| B. | 利用工业酒精与水勾兑制得成本低的饮用白酒 | |
| C. | 为了提高奶制品的蛋白质含量添加三聚氰胺 | |
| D. | 在面包中添加赖氨酸增加营养 |
6.下列几组物质中,俗名与化学式一致的是( )
| A. | 纯碱:Na2CO3•10H2O | B. | 小苏打:NaHCO3 | ||
| C. | 苏打:Na2SO4 | D. | 胆矾:CuSO4•5H2O |
3.下列物质属于碱的是( )
| A. | KCl | B. | O2 | C. | NaOH | D. | HNO3 |
4.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是C
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是CD(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO
(2)CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是C
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是CD(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO
(2)CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
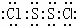 ,属极性分子(填极性或非极性).
,属极性分子(填极性或非极性). +H2O→
+H2O→ +CH3COOH.
+CH3COOH.