题目内容
20.乙烯的产量是衡量一个国家石油化工发展水平的重要标志.下列表述正确的是( )| A. | 乙烯的电子式是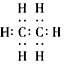 | B. | 乙烯的结构式 CH2=CH2 | ||
| C. | 乙烯分子中所有原子公平面 | D. | 5.6 L乙烯中含有1 mol C-H键 |
分析 A.乙烯分子中含有的是碳碳双键;
B.结构式中需要将所有共价键用短线代替,则乙烯的结构式中碳氢键不能省略;
C.乙烯分子中含有1个碳碳双键,所有原子都共平面;
D.没有告诉在标况下,不能使用标况下的气体摩尔体积计算.
解答 解:A.乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,其正确的电子式为 ,故A错误;
,故A错误;
B.乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,为平面型结构,其正确的结构式为: ,故B错误;
,故B错误;
C.乙烯分子中含有碳碳双键,碳碳键与碳氢键之间夹角120°,其分子中所有原子都共平面,故C正确;
D.不是标况下,不能使用标况下的气体摩尔体积计算5.6L乙烯的物质的量,故D错误;
故选C.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、结构式、物质的量的计算等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
10.化学反应速率的大小主要取决于( )
| A. | 反应物的性质 | B. | 反应物的浓度 | C. | 反应的温度 | D. | 是否使用催化剂 |
11.下列设计的实验方案与对应的现象或结论正确的是( )
| A. | 镁与水的反应实验:取一小段镁带,直接投入试管,向试管中加入2ml水并滴入2滴酚酞溶液,加热试管至沸腾,观察到溶液变红 | |
| B. | 为了确定酸碱中和是放热反应,实验中向10ml 2mol/L NaOH溶液中加入浓硫酸至恰好中和,测定出溶液温度升高 | |
| C. | 原电池能将化学能转化为电能:将锌片和铜片用导线连接(导线中间接入一个电流表),平行插入盛有稀硫酸溶液的烧杯中,观察到电流表指针偏转 | |
| D. | 探究不同催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLFeCl3溶液,向第二试管中加入2mL5%H2O2和少量MnO2粉末,不同的催化剂对化学反应速率的影响不同 |
8.手性碳原子存在于很多有机化合物中,人们将连有四个不同基团的碳原子形象地成为手性碳原子.下列化合物中含有2个手性碳原子的是( )
| A. |  | B. |  | C. | CH3CH2COOH | D. |  |
15.下列有关化学键的说法正确的是( )
| A. | HCl溶于水、NaCl溶于水破坏的化学键类型相同 | |
| B. | 碘升华、NaCl 颗粒被粉碎,均破坏化学键 | |
| C. | 氦气、液溴、硫磺中均存在共价键 | |
| D. | 钠与水反应、钠与氧气反应,均存在离子键的形成 |
5.如图是某有机物分子的比例模型,有关该物质的推断不正确的是( )


| A. | 该有机物的分子式为C3H6O3 | B. | 该有机物分子中含有羟基和羧基 | ||
| C. | 该有机物可以发生消去反应 | D. | 该有机物可以发生加成反应 |
12.分子式为C5H12O的有机物发生消去反应生成的机物有(不含立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
20.如图是课外活动小组设计的用化学电源使LED灯发光装置.下列说法不正确的是( )
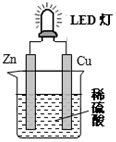

| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成橙汁,导线中不会有电子流动 |
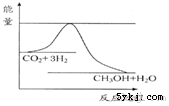 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.