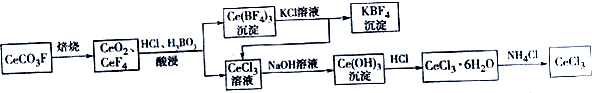
题目内容
11. 用如图示装置制备NO并验证其还原性.
用如图示装置制备NO并验证其还原性.(1)铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)滴入稀硝酸之前,应该关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞.这样操作的目的是消除装置中的氧气.
(3)滴入稀硝酸后,烧杯中的现象是Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色.
(4)烧杯中的反应停止后,打开止水夹,通入氧气可验证NO的还原性.
分析 装置用来制备NO并验证其还原性,先在无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,据此分析,
(1)铜与稀硝酸反应生成硝酸铜、一氧化氮和水,原子守恒配平书写化学方程式;
(2)点燃红磷并伸入瓶中,塞好胶塞和装置内氧气发生反应;除去氧气;
(3)滴入稀硝酸后,稀硝酸具有强氧化性能氧化铜发生反应生成硝酸铜、一氧化氮和水,铜溶解,溶液变蓝色;
(4)一氧化氮和氧气发生反应生成二氧化氮红棕色气体;
解答 解:装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,
(1)铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)滴入稀硝酸之前,应该关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞.这样操作的目的是消除装置中的氧气,故答案为:消除装置中的氧气;
(3)滴入稀硝酸后,发生反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,现象是:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,
故答案为:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色;
(4)打开止水夹,通入少量氧气,一氧化氮遇到氧气会被氧化为二氧化氮,可验证NO的还原性,故答案为:氧气.
点评 本题考查化学实验,一氧化氮的制备和还原性验证的实验操作分析和实验步骤的设计,题目难度中等,注意一氧化氮的制备应在没有氧气条件下进行.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案 室温下,向20.00 mL 0.8mol•L-1一元酸HA溶液中滴入0.8 mol•L-1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00 mL 0.8mol•L-1一元酸HA溶液中滴入0.8 mol•L-1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )| A. | 常温下,1.0 mol•L-1HA的溶液的pH=0 | |
| B. | a、b、c三点,a点混合溶液中c(Na+)最大 | |
| C. | a、b两点的溶液中水的离子积Kw(a)=Kw(b) | |
| D. | c点时消耗NaOH溶液的体积为20.00mL |
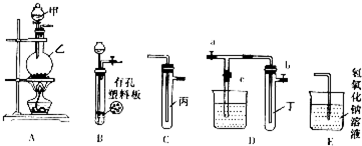
请按要求填空:
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下,请将表格中实验1的现象补充:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有 较强的酸性 |
②若要利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱,则丙中所盛装的试剂为NaBr溶液,能得到结论的实验现象为试管中溶液由无色变为橙色;
③某同学用该装置探究氯气与KI的反应,在丙中盛放有KI淀粉溶液,通入氯气,看到丙中溶液变成蓝色,继续通氯气,发现蓝色逐渐消失,检测到溶液中有含+5价元素的酸根离子,则蓝色消失过量中丙中发生反应的化学方程式是5Cl2+I2+6H2O=2HIO3+10HCl.
(2)B、D、E装置相连后,在B中盛装铜片(放在有孔塑料板上)和浓硝酸,关闭c,打开a、b,即可在试管丁中收集到NO2.
①B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②欲用D装置验证NO2与水的反应,在试管中收集满NO2后,使烧杯中的水进入试管丁的操作是(不可改变试管和烧杯的位置):先关闭止水夹ab,再打开止水夹c,双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中.
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,准确读出反应体系的最高温度 | |
| B. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度,加快油脂皂化反应速率 | |
| D. | 当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
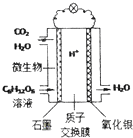 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| B. | 石墨电极上反应为:C6H12O6+6H2O+24e-═6CO2↑+24H+ | |
| C. | 每转移4mol电子,氧化银电极产生22.4LCO2气体(标准状况) | |
| D. | 每30g C6H12O6参与反应,有4mo1 H+经质子交换膜进入正极区 |



 +NaOH→
+NaOH→ +H2O
+H2O .
.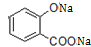 、CH3COONa、CH3OH.
、CH3COONa、CH3OH.