题目内容
1.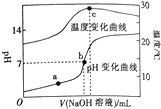 室温下,向20.00 mL 0.8mol•L-1一元酸HA溶液中滴入0.8 mol•L-1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00 mL 0.8mol•L-1一元酸HA溶液中滴入0.8 mol•L-1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )| A. | 常温下,1.0 mol•L-1HA的溶液的pH=0 | |
| B. | a、b、c三点,a点混合溶液中c(Na+)最大 | |
| C. | a、b两点的溶液中水的离子积Kw(a)=Kw(b) | |
| D. | c点时消耗NaOH溶液的体积为20.00mL |
分析 HA与NaOH恰好反应时,反应放热最多,溶液的温度最高,已知c点溶液的温度最高,则c点时,HA与NaOH恰好反应,而此时溶液的pH大于7,说明NaA为强碱弱酸盐,所以HA为弱酸;
A.弱酸在溶液中部分电离;
B.a、b、c三点,c点时,HA与NaOH恰好反应;
C.升高温度促进水的电离;
D.c点时,HA与NaOH恰好反应.
解答 解:HA与NaOH恰好反应时,反应放热最多,溶液的温度最高,已知c点溶液的温度最高,则c点时,HA与NaOH恰好反应,而此时溶液的pH大于7,说明NaA为强碱弱酸盐,所以HA为弱酸;
A.弱酸在溶液中部分电离,所以常温下,1.0 mol•L-1HA的溶液中氢离子浓度小于1mol/L,则pH大于0,故A错误;
B.a、b、c三点,c点时,HA与NaOH恰好反应,即c点混合溶液中c(Na+)最大,故B错误;
C.升高温度促进水的电离,水的电离常数增大,已知b点温度高,所以水的离子积Kw(a)<Kw(b),故C错误;
D.c点时,HA与NaOH恰好反应,所以向20.00 mL 0.8mol•L-1一元酸HA溶液中滴入0.8 mol•L-1的NaOH溶液,消耗NaOH为20mL,故D正确.
故选D.
点评 本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用弱电解质的电离、盐类水解来解答此类习题,题目难度中等.

练习册系列答案
相关题目
18.下列物质加入水中,会显著放热的有( )
| A. | 烧碱 | B. | 硝酸铵 | C. | 氯化钾 | D. | 金属钠 |
12.宋应星在《天工开物.丹青.朱》中记载:“凡朱砂、水银、银朱,原同一物,所以异名着,由精粗老嫩而分也…凡水银与朱更无他出…若水银已升朱,则不可复还为汞,所谓造化之巧已尽也.”(注“即朱砂,主要成分是HgS)下列说法不正确的是( )
| A. | “若水银已升朱”指的是水银气化,属于物理变化 | |
| B. | 朱砂、水银、银朱中均含汞元素,其组成、结构或纯度有所不同 | |
| C. | 常温下,朱砂转化为水银是不自发的过程 | |
| D. | 工业废水中含有汞离子,可以加入FeS固体除去 |
9.在短周期主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数,这四种元素原子的最外层电子数之和为20.下列判断中正确的是( )
| A. | 四种元素中,甲的最高价氧化物对应水化物的酸性最强 | |
| B. | 四种元素中,丙的气态氢化物最稳定 | |
| C. | 乙在自然界中形成的化合物种类最多 | |
| D. | 丁和甲、乙、丙都只能形成一种共价化合物 |
16.化学在生活、生产中应用广泛.下列有关物质的性质和应用均正确的是( )
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 漂白粉和二氧化硫均具有漂白性,将两者混合使用,可增强漂白效果 | |
| C. | 酒精能使蛋白质变性,医院一般用100%的酒精进行消毒 | |
| D. | 氧化铝熔点很高,其制造的坩埚可用于熔融烧碱 |
6.下列实验对应的现象与结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将浓硫酸滴入蔗糖中 | 固体变黑后发生膨胀 | 浓硫酸具有吸水性和强还原性 |
| B | 将两粒相同的钠分别投入乙醇和水中 | 固体在水中反应比在乙醇中剧烈 | 相同条件下,水的电离能力比乙醇强 |
| C | 向某溶液中滴加氯水后再滴入KSCN溶液 | 溶液变为红色溶液变为红色 | 该溶液中一定含有Fe3+ |
| D | 常温时将铝片加入浓硝酸中 | 未出现气泡 | 常温下铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
10.碳循环与人类的生存息息相关(如图所示),下列说法不正确的是( )

| A. | CO2过度排放会导致温室效应 | |
| B. | 植物的光合作用有利于维持大气中O2和 CO2平衡 | |
| C. | 煤和石油的主要成分是有机物 | |
| D. | 碳循环过程中,碳元素均被氧化 |
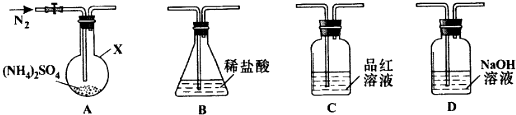
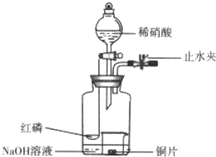 用如图示装置制备NO并验证其还原性.
用如图示装置制备NO并验证其还原性.