题目内容
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g?L-1;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、化合物Y2M4、M2Z2均只含有极性键 |
| C、最高价氧化物对应水化物的酸性:Y>X |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
考点:原子结构与元素周期律的关系,极性键和非极性键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:Y与M形成的气态化合物在标准状况下的密度为0.76g?L-1,该化合物的摩尔质量为0.76g?L-1×22.4L/mol=17g/mol,考虑为NH3,X、Y、Z是原子序数依次递增的同周期元素,故Y为N元素,M为H元素.X与Z可形成XZ2分子,则X位于偶数族,X、Y、Z是原子序数依次递增的同周期元素,则最外层电子数依次增大,最外层电子数之和为15,X、Z的最外层电子数之和为15-5=10,二故Z最外层电子数为偶数,二者平均最外层电子数为5,故Z处于第ⅥA族,X处于第ⅣA族,所以X为C元素,Z为O元素,W的质子数是X、Y、Z、M四种元素质子数之和的
,为
=11,为Na元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
| 1 |
| 2 |
| 6+7+8+1 |
| 2 |
解答:
解:Y与M形成的气态化合物在标准状况下的密度为0.76g?L-1,该化合物的摩尔质量为0.76g?L-1×22.4L/mol=17g/mol,
考虑为NH3,X、Y、Z是原子序数依次递增的同周期元素,故Y为N元素,M为H元素.
X与Z可形成XZ2分子,则X位于偶数族,X、Y、Z是原子序数依次递增的同周期元素,则最外层电子数依次增大,最外层电子数之和为15,X、Z的最外层电子数之和为15-5=10,二故Z最外层电子数为偶数,二者平均最外层电子数为5,故Z处于第ⅥA族,X处于第ⅣA族,所以X为C元素,Z为O元素,
W的质子数是X、Y、Z、M四种元素质子数之和的
,为
=11,为Na元素,
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>C>N>O>H,即W>X>Y>Z>M,故A错误;
B.化合物Y2M4、M2Z2分别为N2H4、H2O2均含有极性键和非极性键,故B错误;
C.Y为N元素、X为C,非金属性N>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D.由X、Y、Z、M四种元素形成的化合物可为氨基酸或碳酸铵、醋酸铵等物质,如为氨基酸,则只含有共价键,故D错误.
故选:C.
考虑为NH3,X、Y、Z是原子序数依次递增的同周期元素,故Y为N元素,M为H元素.
X与Z可形成XZ2分子,则X位于偶数族,X、Y、Z是原子序数依次递增的同周期元素,则最外层电子数依次增大,最外层电子数之和为15,X、Z的最外层电子数之和为15-5=10,二故Z最外层电子数为偶数,二者平均最外层电子数为5,故Z处于第ⅥA族,X处于第ⅣA族,所以X为C元素,Z为O元素,
W的质子数是X、Y、Z、M四种元素质子数之和的
| 1 |
| 2 |
| 6+7+8+1 |
| 2 |
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>C>N>O>H,即W>X>Y>Z>M,故A错误;
B.化合物Y2M4、M2Z2分别为N2H4、H2O2均含有极性键和非极性键,故B错误;
C.Y为N元素、X为C,非金属性N>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D.由X、Y、Z、M四种元素形成的化合物可为氨基酸或碳酸铵、醋酸铵等物质,如为氨基酸,则只含有共价键,故D错误.
故选:C.
点评:本题考查元素推断、元素周期律、分子结构及C、N、Na元素化合物性质等,为高考常见题型,侧重于学生的分析能力的考查,难度中等,根据密度判断Y与M形成的气态化合物是氨气为推断的关键,注意X、Z元素推断奇偶性的利用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
25℃时,下列各组离子在指定溶液中能大量共存的是( )
| A、滴人甲基橙显红色的溶液中:NH4+、Ba2+、AlO-2、Cl- | ||||
B、Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、Si
| ||||
C、含有较多S
| ||||
D、澄清透明溶液中:K+、Mn
|
下列各组离子在所给条件下能够大量共存的是( )
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2- |
| C、使紫色石蕊试液显蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42- |
| D、溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH- |
能正确表示下列反应的离子方程式是( )
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- |
| D、将0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
下列关于物质的量、摩尔质量的叙述中正确的是( )
| A、0.012kg12C中含有约6.02×1023个碳原子 |
| B、1molH2O中含有2 mol氢和1mol氧 |
| C、氢氧化钠的摩尔质量是40g |
| D、2mol水的摩尔质量是1mol水的摩尔质量的2倍 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、一定温度下,pH=6的纯水中含有OH-的数目为10-6 NA |
| B、120 g NaHSO4固体中含有的离子总数为2NA |
| C、标准状况下,22.4 L己烷中所含分子的数目为NA |
| D、100 mL 0.5 mol?L-1 的(NH4)2SO4 溶液中,NH4+的数目为 0.1 NA |
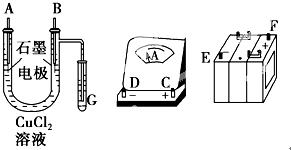 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为: