题目内容
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
下列判断不正确的是( )
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、b>f |
| B、K(1000℃)>K(810℃) |
| C、915℃、2.0MPa时E的转化率为60% |
| D、该反应的△S>0 |
考点:化学平衡的计算
专题:化学平衡专题
分析:同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0>a>b,所以f>b;在915℃、2M Pa下,设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得
=75%,解得x=0.6;该题是气体体积增大的反应,因此为熵增反应;结合前面分析知升温平衡正向移动,则平衡常数增大.
| 2ax |
| a-ax+2ax |
解答:
解:A、同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0>a>b,所以f>b,故A错误;
B、利用图表分析结合平衡原理分析;a与b、c与d、e与f之间是压强问题,随着压强增大,平衡逆向移动,G的体积分数减小,b<a;c>75%,e>83%;c、e是温度问题,随着温度升高,G的体积分数增大,所以正反应是一个吸热反应,所以,K(1000℃)>K(810℃)故B正确;
C、设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得
=75%,解得x=0.6,α=60%,故C正确;
D、该反应是一个气体分子增大的反应,属于熵增反应,故D正确;
故选A.
B、利用图表分析结合平衡原理分析;a与b、c与d、e与f之间是压强问题,随着压强增大,平衡逆向移动,G的体积分数减小,b<a;c>75%,e>83%;c、e是温度问题,随着温度升高,G的体积分数增大,所以正反应是一个吸热反应,所以,K(1000℃)>K(810℃)故B正确;
C、设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得
| 2ax |
| a-ax+2ax |
D、该反应是一个气体分子增大的反应,属于熵增反应,故D正确;
故选A.
点评:本题考查化学平衡影响因素分析,数据处理的方法应用,平衡计算和对比判断是解题关键,题目难度中等.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、Na2O2加入水制备O2:2O22-+2H2O=4OH-+O2↑ |
| B、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4LCCl4含有NA个分子 |
| B、0.1molAlCl3完全转化为胶体,生成胶体粒子的数目为0.l NA个 |
| C、常温常压下46gNO2和N2O4的混合气体含有3NA个原子 |
| D、0.1molCl2与足量冷的NaOH溶液反应,转移电子数为0.2 NA |
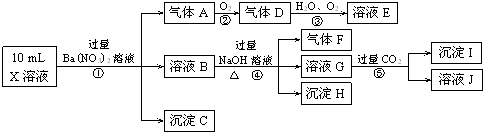
溶液X中可能含有K+、Mg2+、Al3+、AlO2-、SiO32-、CO32-、SO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:

下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、沉淀乙为Mg(OH)2 |
| C、沉淀甲是硅酸和硅酸镁的混合物 |
| D、溶液X中一定存在K+、AlO2-和SiO32-离子 |
如图所示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )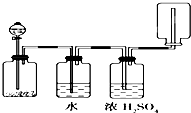

| A、KMnO4分解生成氧气 |
| B、二氧化锰和盐酸生产氯气 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、锌和盐酸生成氢气 |