题目内容
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是( )
| A、少量BaCl2固体,v(H2)减小 |
| B、VmLNa2SO4溶液,v(H2)不变 |
| C、少量CuSO4溶液,v(H2)增大 |
| D、VmL稀硝酸,v(H2)增大 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:对应锌与稀硫酸的反应,增大稀硫酸浓度、升高反应温度、增大固体的表面积以及形成原电池反应都可增大反应速率,以此解答该题.
解答:
解:A.加入少量BaCl2固体,氢离子物质的量不变,反应速率不变,故A错误;
B.加入VmLNa2SO4溶液,氢离子物质的量不变,但溶液体积增大,则反应速率减小,故B错误;
C.加入少量CuSO4溶液,锌置换出铜,可形成原电池反应,加快反应速率,故C正确;
D.硝酸具有强氧化性,可与锌反应生成NO,不生成氢气,故D错误.
故选C.
B.加入VmLNa2SO4溶液,氢离子物质的量不变,但溶液体积增大,则反应速率减小,故B错误;
C.加入少量CuSO4溶液,锌置换出铜,可形成原电池反应,加快反应速率,故C正确;
D.硝酸具有强氧化性,可与锌反应生成NO,不生成氢气,故D错误.
故选C.
点评:本题考查影响化学反应速率的因素,为高频考点,注意温度、浓度、压强、接触面积、原电池反应等对反应速率的影响即可解答,易错点为D,注意硝酸的性质,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 水、浓硫酸 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 萃取 |
| A、A | B、B | C、C | D、D |
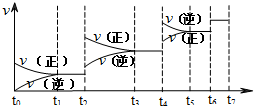 可逆反应C(s)+H2O(g)═H2(g)+CO(g),△H>0达
可逆反应C(s)+H2O(g)═H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件,反应速率v与时间t的关系
如图.图中表示平衡混合物中CO的含量最高的一段时间
是( )
| A、t1-t2 |
| B、t3-t4 |
| C、t5-t6 |
| D、t6-t7 |
下列说法不正确的是( )
| A、动态平衡状态在自然界和工农业生产中很少见 |
| B、化学反应的速率和限度均可通过改变相应的化学反应条件而改变 |
| C、物质发生化学反应都伴随着能量变化 |
| D、化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
下列有关化学反应速率的说法正确的是( )
| A、100 mL 1 mol?L-1的硫酸跟锌片反应,加入适量的硫酸钠溶液,反应速率不变 |
| B、SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 |
| C、汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
| D、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率v(Z)=2.0×10-3mol/(L?min) |
| B、其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) |
| C、该温度下此反应的平衡常数K=144 |
| D、其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大 |
