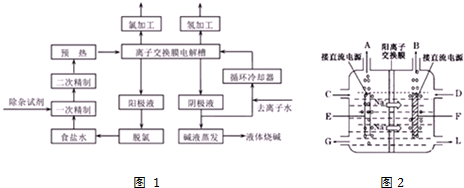
题目内容
18.对溶液中的离子反应存在下列几种说法,其中正确的是( )| A. | 不可能是氧化还原反应 | B. | 只能是复分解反应 | ||
| C. | 可能是置换反应 | D. | 可能是化合反应 |
分析 有离子参加或生成的反应为离子反应,有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,结合实例分析解答.
解答 解:A.溶液中的离子反应可能为氧化还原反应,如:2Fe2++Cl2=2Fe 3++2Cl-,故A错误;
B.溶液中的离子反应不一定是复分解反应,如Cu2++Fe=Fe2++Cu,属于置换反应,故B错误;
C.在溶液存在的离子反应,可能属于置换反应,如:Cu2++Fe=Fe2++Cu,故C正确;
D.在溶液存在的离子反应,可能属于化合反应,如氯化亚铁与氯气的反应:2Fe2++Cl2=2Fe 3++2Cl-,故D正确;
故选CD.
点评 本题考查氧化还原反应及反应类型判断,为高频考点,把握离子反应及氧化还原反应的判断为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
8.在1~20号元素中关于某些元素的性质说法错误的是( )
| A. | Cl的最高氧化物对应的水化物酸性最强 | |
| B. | S元素的族序数等于周期数3倍 | |
| C. | C元素的最高正价与最低负价代数和为零 | |
| D. | N元素的气态氢化物和它的最高价氧化物对应水化物能起化合反应 |
9.下列关于乙烯和乙烷的说法中,错误的是( )
| A. | 乙烯是不饱和烃,乙烷是饱和烃 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,乙烷则不能 | |
| C. | 乙烯分子中存在碳碳双键,乙烷分子中存在碳碳单键,因此乙烯比乙烷稳定 | |
| D. | 乙烯分子为平面形结构,乙烷分子为立体结构 |
13.下列有关化学反应现象或化学原理的解释正确的是( )
| 选项 | 现象或反应 | 原理解释 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 合成氨反应需在高温条件下进行 | 该反应为吸热反应 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A. | A | B. | B | C. | C | D. | D |
10.沸腾时只需克服范德华力的液体物质是( )
| A. | 水 | B. | 酒精 | C. | 四氯化碳 | D. | 氨水 |
8.硼有两种天然同位素${\;}_{5}^{10}$B、${\;}_{5}^{11}$B,假设硼元素的相对原子质量为10.2,则${\;}_{5}^{11}$B的质量分数为( )
| A. | 20% | B. | 80% | C. | 78.4% | D. | 21.6% |
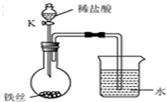 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.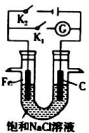 将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:
将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置: