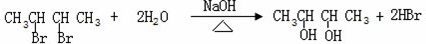题目内容
使0.1mol某有机物完全燃烧,用去0.4molO2,生成6.72L(标准状况)CO2和5.4gH2O.已知该有机物能发生银镜反应.试通过计算确定该有机物的化学式和结构简式.
分析:根据n=
和n=
计算CO2、H2O物质的量,根据氧原子守恒判断有机物中是否含有氧元素确定有机物的分子式,结合结构特点可确定有机物分子式.
| m |
| M |
| V |
| Vm |
解答:解:n(CO2)=
=0.3moL,n(H2O)=
=0.3mol,
由O元素质量守恒可知0.1mol有机物含有n(O)=0.3mol×2+0.3mol-2×0.4mol=0.1mol,
则1mol有机物含有3molC,6molH,1molO,
所以分子式为C3H6O,
该有机物能发生银镜反应,应含有醛基,
则有机物的结构简式为CH3CH2CHO,
答:该有机物的化学式和结构简式分别为C3H6O、CH3CH2CHO.
| 6.72L |
| 22.4L/mol |
| 5.4g |
| 18g/mol |
由O元素质量守恒可知0.1mol有机物含有n(O)=0.3mol×2+0.3mol-2×0.4mol=0.1mol,
则1mol有机物含有3molC,6molH,1molO,
所以分子式为C3H6O,
该有机物能发生银镜反应,应含有醛基,
则有机物的结构简式为CH3CH2CHO,
答:该有机物的化学式和结构简式分别为C3H6O、CH3CH2CHO.
点评:本题考查有机物分子式确定的计算,题目难度中等,注意从质量守恒的角度确定是否含有氧元素,为解答该题的关键,也是易错点.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目