题目内容
欲增大Mg(OH)2在水中的溶解度,可采用的方法是( )
| A、增大pH |
| B、加入2.0 mol?L-1NH4Cl固体 |
| C、加入MgSO4,固体 |
| D、加入适量95%乙醇 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:Mg(OH)2在水中存在沉淀溶解平衡,欲增大Mg(OH)2在水中的溶解度,则需使溶解平衡正向移动,所以要根据沉淀溶解平衡的影响因素分析,选择合适的改变溶解度的方法.
解答:
解:A、增大溶液pH值,溶液中c(OH-)增大,Mg(OH)2的溶解平衡逆移,溶解度降低,故A错误;
B、加入2.0 mol?L-1NH4Cl,由于NH4+与OH-结合使溶液中c(OH-)减小,Mg(OH)2的溶解平衡正移,溶解度增大,故B正确;
C、加入0.1 mol?L-1MgSO4,c(Mg2+)增大,Mg(OH)2的溶解平衡逆移,溶解度降低,故C错误;
D、加入适量95%乙醇,对Mg(OH)2在水中的溶解度无影响,故D错误;
故选:B.
B、加入2.0 mol?L-1NH4Cl,由于NH4+与OH-结合使溶液中c(OH-)减小,Mg(OH)2的溶解平衡正移,溶解度增大,故B正确;
C、加入0.1 mol?L-1MgSO4,c(Mg2+)增大,Mg(OH)2的溶解平衡逆移,溶解度降低,故C错误;
D、加入适量95%乙醇,对Mg(OH)2在水中的溶解度无影响,故D错误;
故选:B.
点评:本题考查了影响沉淀溶解平衡的因素,题目难较小,注意把握影响沉淀溶解平衡的因素,侧重于基础知识的考查.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.40mol/L.则原混合物中氧化铁的质量是( )
| A、2.4g | B、3.6g |
| C、5.6g | D、6.4g |
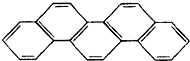 有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )
有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )| A、该烃属于烯烃 |
| B、该烃分子中只含非极性键 |
| C、该烃的二氯代物只有一种 |
| D、该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
已知Kφ(AgCl)=1.8×10-10mol2?L-2,Kφ(AgBr)=5.0×10-13mol2?L-2,Kφ(Ag2CrO4)=9.0×10-12mol2?L-3.某溶液中含有Cl-、Br-和CrO42-,浓度均为0.10mol?L-1,向该溶液中逐滴加入0.10mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A、Cl-、Br-、CrO42- |
| B、CrO42-、Br-、Cl- |
| C、Br-、Cl-、CrO42- |
| D、Br-、CrO42-、Cl- |
合成氨的温度和压强通常控制在约500℃以及200~500atm的范围,且进入合成塔的N2和H2的体积比为1:3,经科学测定,在相应条件下,N2和H2反应所得氨的平衡浓度(体积分数)如下表所示.
而实际从合成塔出来的混合气体中含有氨约为15%,这表明( )
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |
向足量H2SO4溶液中加入100mL 0.4mol?L-1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol?L-1盐酸时,放出的热量为2.2 kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-2.92 kJ?mol-1 |
| B、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-18 kJ?mol-1 |
| C、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-73 kJ?mol-1 |
| D、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-0.72 kJ?mol-1 |