题目内容
下列有关化学反应速率的说法正确的是( )
| A、化学反应速率只能用一定时间内反应物浓度的减少来表示 |
| B、化学反应速率的大小主要取决于反应物的性质 |
| C、化学反应达到最大限度时,正逆反应速率也达到最大且相等 |
| D、用铁片和稀硫酸反应制取氢气时改用98%浓硫酸可以加快产生氢气的速率 |
考点:化学反应速率的影响因素,化学反应速率的概念
专题:化学反应速率专题
分析:反应速率可用一定时间内反应物浓度的减少或生成物浓度的增多来表示,为平均速率,影响反应速率的主要因素为物质的本身性质,为内因,温度、压强、浓度、催化剂等为次要因素,为外因,达到平衡时,正逆反应速率相等,以此解答.
解答:
解:A.反应速率可用一定时间内反应物浓度的减少或生成物浓度的增多来表示,故A错误;
B.影响反应速率的主要因素为物质的本身性质,为内因,温度、压强、浓度、催化剂等为次要因素,为外因,故B正确;
C.化学反应达到最大限度时,正逆反应速率相等,但不一定最大,故C错误;
D.浓硫酸与铁发生钝化反应,如加热条件下反应生成二氧化硫气体,不生成氢气,故D错误.
故选B.
B.影响反应速率的主要因素为物质的本身性质,为内因,温度、压强、浓度、催化剂等为次要因素,为外因,故B正确;
C.化学反应达到最大限度时,正逆反应速率相等,但不一定最大,故C错误;
D.浓硫酸与铁发生钝化反应,如加热条件下反应生成二氧化硫气体,不生成氢气,故D错误.
故选B.
点评:本题考查化学反应速率知识,为高频考点,侧重于基本概念的理解和运用的考查,易错点为D,注意浓硫酸的性质,难度不大.

练习册系列答案
相关题目
下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是( )
| A、HCl+NH3=NH4Cl |
| B、2Na+2H2O=2NaOH+H2↑ |
| C、2KClO3=2KCl+3O2↑ |
| D、Ba(OH)2?8H2O+2 NH4Cl=BaCl2+NH3↑+10H2O |
在水溶液中能大量共存的一组是( )
| A、Fe2+ Al3+ ClO- Cl- |
| B、K+Fe3+OH- NO3- |
| C、NH4+ Na+ Br- SO42- |
| D、Na+ H+ SiO32- SO42- |
某气体可能含有N2、HCl、CO中的一种或几种,将其依次通入足量NaHCO3溶液和灼热CuO,气体的体积都没有变化,再通过足量的碱石灰,气体体积减小,但还有剩余气体,以下对该气体组分判断正确的是( )
| A、一定没有N2,CO和HCl至少有1种 |
| B、一定有N2,HCl和CO |
| C、一定有N2,CO和HCl至少有1种 |
| D、一定有N2和CO,没有HCl |
下列各组混合物中,能用溶解、过滤、蒸发的方法进行分离的是( )
| A、酒精和水 |
| B、食盐和泥沙 |
| C、水和四氯化碳 |
| D、汽油和植物油 |
设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,以任意比例混合的CH4与CO2 的混合物22.4L,所含有的分子数为NA |
| B、在标准状况下,NA个H2O 分子所占体积为22.4L |
| C、常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
下列离子方程式书写正确的是( )
A、澄清石灰水与过量NaHCO3溶液混合:Ca2++OH-+HCO
| ||
B、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO
| ||
| C、锌和稀硝酸的反应:Zn2++2H+=Zn2++H2 | ||
| D、CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+ |
某有机物结构简式如图所示(未表示出其空间构型).下列它的性质描述不正确的是( )
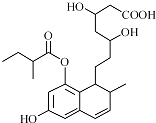

| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |
下列热化学方程式或离子方程式中,正确的是( )
| A、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| B、向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3↓+CaCO3↓+2H2O |
| C、乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(g)△H=-akJ/mol |
| D、Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |