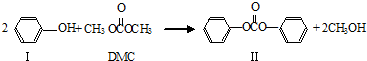题目内容
下列有关物质的性质和该性质的应用均正确的是( )
| A、铝的熔点很高,可用于制作耐高温材料 |
| B、浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| C、油脂能在酸性溶液中水解生成高级脂肪酸,可用于防止油脂变质 |
| D、过氧化钠能与二氧化碳反应产生氧气,可用于高空飞行或潜水的供氧剂 |
考点:铝的化学性质,浓硫酸的性质,钠的重要化合物,油脂的性质、组成与结构
专题:元素及其化合物
分析:A.氧化铝的熔点高,作耐火材料;
B.干燥剂不能与被干燥的气体反应;
C.油脂发生氧化反应会变质;
D.过氧化钠能与二氧化碳反应产生氧气,可提供氧气.
B.干燥剂不能与被干燥的气体反应;
C.油脂发生氧化反应会变质;
D.过氧化钠能与二氧化碳反应产生氧气,可提供氧气.
解答:
解:A.氧化铝的熔点高,作耐火材料,而Al的熔点较低,不能作耐火材料,故A错误;
B.干燥剂不能与被干燥的气体反应,则浓硫酸具有吸水性,可用于干燥二氧化碳等气体,不能干燥氨气,故B错误;
C.油脂发生氧化反应会变质,则防止油脂变质与油脂能在酸性溶液中水解生成高级脂肪酸无关,故C错误;
D.过氧化钠能与二氧化碳反应产生氧气,可提供氧气,且过氧化钠为固体,运输及携带方便,用于高空飞行或潜水的供氧剂,故D正确;
故选D.
B.干燥剂不能与被干燥的气体反应,则浓硫酸具有吸水性,可用于干燥二氧化碳等气体,不能干燥氨气,故B错误;
C.油脂发生氧化反应会变质,则防止油脂变质与油脂能在酸性溶液中水解生成高级脂肪酸无关,故C错误;
D.过氧化钠能与二氧化碳反应产生氧气,可提供氧气,且过氧化钠为固体,运输及携带方便,用于高空飞行或潜水的供氧剂,故D正确;
故选D.
点评:本题考查物质的性质,综合考查元素化合物性质,综合性较强,注意把握物质的性质、发生的反应为解答的关键,注意性质、用途的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺.这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等.该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气.合金中镓(Ga)是关键成分,可阻止铝形成致密的氧化膜.下列关于铝、镓的说法正确的是( )
| A、铝、镓合金与水反应后的物质可以回收利用冶炼铝 |
| B、铝的金属性比镓强 |
| C、铝镓合金的熔点比铝低 |
| D、Ga(OH)3与Al(OH)3性质相似,能与NaOH溶液反应 |
能在溶液中大量共存的一组离子是( )
| A、H+、Na+、AlO2─、HCO3─ |
| B、Ba2+、NH4+、CO32-、Cl─ |
| C、K+、Fe2+、OH─、SO32─ |
| D、Na+、Ba2+、OH─、NO3─ |
下列判断合理的是( )
①等物质的量的NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后生成CO2的质量相等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥合金的熔点通常比组分金属高,硬度比组分金属大.
①等物质的量的NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后生成CO2的质量相等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥合金的熔点通常比组分金属高,硬度比组分金属大.
| A、只有②⑥ |
| B、只有②⑤ |
| C、只有①②⑤⑥ |
| D、只有②③④⑤ |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L的戊烷所含的分子数为0.5 NA |
| B、26g乙炔所含共用电子对数目为3 NA |
| C、标准状况下,11.2 L CCl4所含分子数为0.5 NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
下列实验不能达到预期目的是( )
| A、用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸 |
| B、向某溶液中滴入稀盐酸与氯化钡的混合溶液,检验该溶液中是否含有SO42- |
| C、将颗粒大小相同的钠与钾分别与水反应,比较钠、钾金属活泼性的强弱 |
| D、将Mg(OH)2和Al(OH)3分别与过量NaOH溶液反应,比较其碱性的强弱 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A、
| ||
| B、0.1mol?L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl- | ||
| C、0.1mol?L-1FeCl3 溶液:K+、NH4+、I-、SCN- | ||
| D、使甲基橙变红色的溶液:K+、Al3+、Cl-、NO3- |
 2011年9月23日,中国科学家屠呦呦获得了美国拉斯克医学奖的临床医学奖,获奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
2011年9月23日,中国科学家屠呦呦获得了美国拉斯克医学奖的临床医学奖,获奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A、青蒿素分子式为C15H22O5 |
| B、青蒿素有-O-O-键具有较强的氧化性 |
| C、青蒿素易溶于水、乙醇、苯 |
| D、青蒿素在碱性条件下易发生水解反应 |