题目内容
16.下列各溶液中,Na+ 物质的量浓度最大的是( )| A. | 4L 0.5 mol/L NaCl 溶液 | B. | 1L 0.3 mol/L Na2SO4 溶液 | ||
| C. | 0.8L 0.4 mol/L NaOH 溶液 | D. | 2L 0.15 mol/L Na3PO4 溶液 |
分析 电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,据此结合选项判断.
解答 解:A、4L 0.5mol•L-1的NaCl溶液中Na+浓度为0.5mol/L×1=0.5mol/L;
B、1L 0.3mol/LNa2SO4溶液中Na+浓度为0.3mol/L×2=0.6mol/L;
C、0.8L 0.4mol•L-1的NaOH溶液中Na+浓度为0.4mol/L×1=0.4mol/L;
D、2L 0.15mol/LNa3PO4溶液Na+浓度为0.15mol/L×3=0.45mol/L;
故选B.
点评 本题考查物质的量浓度,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算.

练习册系列答案
相关题目
9.镁粉中混进少量铝粉,将Al粉除去,可选用的试剂是( )
| A. | 盐酸 | B. | CuSO4溶液 | C. | NaOH溶液 | D. | H2O |
9.在25℃、1.01×105Pa下,将22gCO2通入到750mL1.0mol•L-1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
5.新型无机非金属材料氮化硼(BN)可用于火箭的燃料喷嘴.已知BN可以在高温下通过:B2O3(s)+2NH3(g)$\frac{\underline{\;高温\;}}{\;}$2BN(s)+3H2O(g)反应制得,实际中还添加Ca3(PO4)3作为填料,以降低B2O3熔体的黏度.下列有关说法正确的是( )
| A. | 反应中B2O3是氧化剂 | B. | 若消耗2.24LNH3理论上可得2.5gBN | ||
| C. | 填料的作用可使反应物充分接触 | D. | 反应时NH3需要用无水CaCl2干燥 |
8.已知某些气态烃可以在氯气中燃烧,如:CH4+2Cl2$\stackrel{点燃}{→}$C+4HCl,现将一定量的某烃分成两等份,分别在氯气和氧气中燃烧,测得消耗的氯气和氧气在同温同压下的体积比为3:3.5,则该烃的分子式为( )
| A. | C2H4 | B. | C2H6 | C. | C3H6 | D. | C4H8 |
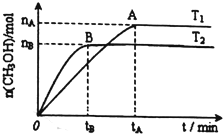 科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.
科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.
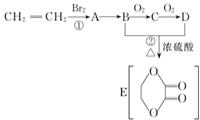 由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)
由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)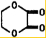 +2H2O.
+2H2O.


