题目内容
11. 科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.
科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.请回答下列问题:
(1)写成表示H2(g)的燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol.
(2)用太阳能分解36g水消耗的能量是571.6kJ.
(3)CH3OH(l)不完全燃烧生成一CO和液态水的热化学方程式为.CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
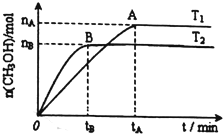
(4)在容积为2L的恒容密闭容器中,由CO2和H2合成甲醇,其反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验结果如图所示:
①试写出上述反应的平衡常数的表达式K=$\frac{C(C{H}_{3}OH)•C({H}_{2}O)}{C(C{O}_{2})•{C}^{3}({H}_{2})}$;
②处于A点的反应体系从T1变到T2,达平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大(填”“增大”、“减小”或“不变”).
③保持温度时,将1molCO2和3molH2,充分反应后达平衡,若CO2转化率为a,则容器内平衡时压强与起始压强之比为(2-a):2.
④下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)、n(H2)和混合气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC(填标号).

分析 (1)H2(g)的燃烧热分别为285.8kJ•mol-1、,据热化学方程式的含义,H2的标准燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;(2)氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(3)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(4)①、根据平衡常数的定义再结合方程式直接写出平衡常数的表达式;
②处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故达平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大;
③根据CO2的转化率求得平衡时各物质的物质的量,压强之比等于物质的量之比,从而求得结论;
④反应达到平衡状态时,同一物质的正逆反应速率相等,平衡时各种物质的物质的量浓度、百分含量等不再发生变化,以及由此衍生的一些量也不发生变化,说明可逆反应到达平衡状态,结合图象分析.
解答 解:(1)H2(g)的燃烧热分别为285.8kJ•mol-1、,据热化学方程式的含义,H2的标准燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(2)H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,36g水的物质的量为2mol,则分解2mol H2O(l)消耗的能量为285.8kJ×2=571.6kJ,
故答案为:571.6kJ;
(3)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(4)①根据平衡常数的定义再结合方程式CO2(g)+3H2(g)?CH3OH(g)+H2O(g),可知平衡常数的表达式为:K=$\frac{C(C{H}_{3}OH)•C({H}_{2}O)}{C(C{O}_{2})•{C}^{3}({H}_{2})}$,
故答案为:K=$\frac{C(C{H}_{3}OH)•C({H}_{2}O)}{C(C{O}_{2})•{C}^{3}({H}_{2})}$;
②处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故达平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故答案为:增大;
③由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 1 3 0 0
变化 a 3a a a
平衡 1-a 3-3a a a
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:(2-a):2;
④A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B.随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C.n(H2)不变,正逆反应速率相等,即是平衡状态,故C正确;
D.容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
故答案为:BC.
点评 本题考查了盖斯定律、热化学方程式的书写、化学平衡常数、影响平衡的因素、化学平衡的计算、原电池的电极反应等内容,考查的点较多,知识夸度大,对学生来讲有一定的难度.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| 物质 | 乙醛 | 乙酸 | 甘油[X& | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
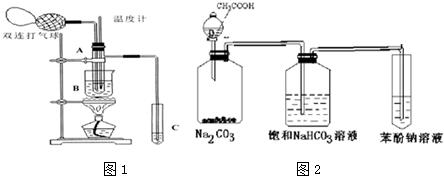
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{68℃-80℃}^{CuO}$2CH3COOH.
(2)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(3)若想检验试管C中是否含有产物乙酸,在下列提供的试剂和试纸中可以选用ad.(填序号).实验仪器任选.所提供的试剂和试纸有:
a.pH试纸 b.红色的石蕊试纸 c.白色的醋酸铅试纸 d.碳酸氢钠粉末.
(4)实验室可以用下列装置如图2来探究乙酸、苯酚、碳酸的酸性强弱.
①饱和碳酸氢钠溶液的作用是除去乙酸.
②苯酚钠溶液中应观察到溶液变浑浊,有关的化学方程式C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.
| 化学键 | H-H | O=O |
| 键能/kJ/mol | 436 | 498 |
| A. | 463.4kJ/mol | B. | 926.8kJ/mol | C. | 221.6kJ/mol | D. | 413kJ/mol |
| A. | 4L 0.5 mol/L NaCl 溶液 | B. | 1L 0.3 mol/L Na2SO4 溶液 | ||
| C. | 0.8L 0.4 mol/L NaOH 溶液 | D. | 2L 0.15 mol/L Na3PO4 溶液 |
| A. | 含1.2NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的物质的量浓度为0.6mol•L-1 | |
| B. | Na在空气中长期放置变成Na2CO3粉末 | |
| C. | 过量的澄清石灰水分别与Na2CO3溶液和NaHCO3溶液反应,现象不同 | |
| D. | 滴加KSCN显红色的溶液中可大量存在NH4+、K+、Cl-、I- |

下列叙述不正确的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | Y既能发生取代反应,也能发生加成反应 | |
| C. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
