题目内容
反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,试回答:
①增加C的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率 .
③保持体积不变,充入N2使体系压强增大,其逆反应速率 .
④保持压强不变,充入N2使容器的体积增大,其正反应速率 .
①增加C的量,其正反应速率的变化是
②将容器的体积缩小一半,其正反应速率
③保持体积不变,充入N2使体系压强增大,其逆反应速率
④保持压强不变,充入N2使容器的体积增大,其正反应速率
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据外界条件对化学反应速率的影响判断,影响反应速率的因素有温度、浓度、压强、催化剂和固体的接触面积.
解答:
解:①因C是固体,增加C的量,没有增加C的浓度,所以不能改变反应速率,故答案为:不变;
②容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快,故答案为:增大;
③体积不变,充入N2使体系压强增大,但各物质的浓度不变,所以反应速率不变,故答案为:不变;
④压强不变,充入N2使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小,故答案为:减小.
②容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快,故答案为:增大;
③体积不变,充入N2使体系压强增大,但各物质的浓度不变,所以反应速率不变,故答案为:不变;
④压强不变,充入N2使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小,故答案为:减小.
点评:注意:1、浓度对化学反应速率的影响适用范围是溶液或气体.
2、压强对化学反应速率的影响是通过改变物质的浓度影响的.
3、温度对化学反应速率的影响适用于所有化学反应,无论该反应是放热反应还是吸热反应.
2、压强对化学反应速率的影响是通过改变物质的浓度影响的.
3、温度对化学反应速率的影响适用于所有化学反应,无论该反应是放热反应还是吸热反应.

练习册系列答案
相关题目
下列几种物质的保存方法中,不妥的是( )
| A、漂白粉可以在敞口容器中长期存放 |
| B、氯水保存在棕色瓶里并放在冷暗处 |
| C、液氯保存在绿色的干燥钢瓶中 |
| D、溴水盛放在有玻璃塞的细口瓶中 |
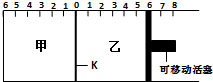 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )| A、根据隔板K滑动与否不能判断左右两边的反应是否达到平衡 |
| B、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
| C、到达平衡时,甲容器中C的物质的量等于乙容器中C的物质的量 |
| D、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
下列有关物质用途的叙述错误的是( )
| A、纯碱是重要的化工原料之一,可用于制化学品、清洗剂、洗涤剂 |
| B、氢氧化铝常用于治疗胃病 |
| C、NO可用于某些疾病的治疗;SO2可用于食品防腐剂 |
| D、明矾具有消毒杀菌作用,可用于净水;硫酸钡可用于钡餐透视 |
R、X、Y和Z四种元素,它们常见的化合价均为+2价,且X2+与单质R不反应;X2++Z═X+Z2+;Y+Z2+═Y2++Z.这四种离子被还原成0价时,表现的氧化性强弱顺序正确的是( )
| A、R2+>X2+>Z2+>Y2+ |
| B、X2+>R2+>Y2+>Z2+ |
| C、Y2+>Z2+>R2+>X2+ |
| D、Z2+>X2+>R2+>Y2+ |
下列既属于氧化还原反应,又属于吸热反应的是( )
| A、甲烷(CH4)在O2中的燃烧反应 |
| B、铝片与稀盐酸反应 |
| C、Ba(OH)2?8H2O与NH4Cl的反应 |
| D、灼热的炭与水蒸气的反应 |
金属冶炼一般有下列四种方法:①焦炭法 ②水煤气(或H2、CO)法 ③活泼金属置换法④电解法.这四种方法在工业上均有应用.古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜.现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁.对它们的冶炼方法的分析,不正确的是( )
| A、(Ⅰ),① |
| B、(Ⅱ),② |
| C、(Ⅲ),③ |
| D、(Ⅳ),④ |
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )


| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol |
| B、b曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、升高温度,正、逆反应速率都增大,平衡向逆方向移动 |