题目内容
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: | ||
B、NH4Cl的电子式: | ||
C、原子核内有10个中子的氧原子:
| ||
| D、乙烯的结构式为:CH2=CH2 |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.硫原子核外电子总数为16,最外层为6个电子;
B.氯化铵的电子式中,氯原子没有标出最外层电子;
C.氧原子的质子数为8,中子数为10的氧原子的质量数为18;
D.结构式中需要用短线表示出所有的共用电子对.
B.氯化铵的电子式中,氯原子没有标出最外层电子;
C.氧原子的质子数为8,中子数为10的氧原子的质量数为18;
D.结构式中需要用短线表示出所有的共用电子对.
解答:
解:A.硫原子的最外层电子为6,硫原子正确的电子式为: ,故A错误;
,故A错误;
B.氯化铵为离子化合物,铵根离子和氯离子都需要标出最外层电子,正确的电子式为: ,故B错误;
,故B错误;
C.氧原子的核电荷数为8,原子核内有10个中子的氧原子的质量数为18,该氧原子可以表示为:
O,故C正确;
D.乙烯为平面机构,乙烯分子中存在一个碳氧双键和4个碳氢键,CH2=CH2为乙烯的结构简式,乙烯的结构式为: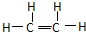 ,故D错误;
,故D错误;
故选C.
 ,故A错误;
,故A错误;B.氯化铵为离子化合物,铵根离子和氯离子都需要标出最外层电子,正确的电子式为:
 ,故B错误;
,故B错误;C.氧原子的核电荷数为8,原子核内有10个中子的氧原子的质量数为18,该氧原子可以表示为:
18 8 |
D.乙烯为平面机构,乙烯分子中存在一个碳氧双键和4个碳氢键,CH2=CH2为乙烯的结构简式,乙烯的结构式为:
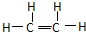 ,故D错误;
,故D错误;故选C.
点评:本题考查了电子式、原子结构示意图、结构式、元素符号的表示方法,题目难度中等,注意掌握常见的化学用语的表示方法,明确离子化合物与共价化合物的电子式的区别.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、2011年诺贝尔化学奖授予以色列科学家达尼埃尔?谢赫特曼,以表彰他发现了准晶体.化学式为Al63Cu24Fe13的准晶体可与稀硝酸发生反应. |
| B、分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 |
| C、绿色化学的核心是应用化学原理对环境污染进行治理 |
| D、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Na+、H+、CO32-、Cl- |
| B、H+、Fe2+、Cl-、NO3- |
| C、Na+、Al3+、OH-、Cl- |
| D、NH4+、H+、OH-、NO3- |
在分子式为C4H10O的有机物中,含有-OH的同分异构体有(不考虑立体异构)( )
| A、5种 | B、4种 | C、3种 | D、2种 |
 2013年,我国部分地区发生了禽流感.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如图所示,下列是有关金丝桃素说法:其中错误的是( )
2013年,我国部分地区发生了禽流感.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如图所示,下列是有关金丝桃素说法:其中错误的是( )①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23NO3,苯环上的一氯取代物有3种
④1mol该物质最多能和6mol H2发生加成反应.
| A、①和④ | B、②和③ |
| C、①和③ | D、②和④ |
下列物质互为同分异构体的是( )
| A、葡萄糖和果糖 |
| B、淀粉和纤维素 |
| C、氧气和臭氧 |
| D、乙烷和丙烷 |
下列有关微粒半径大小的比较中,正确的是( )
| A、Na+>F- |
| B、Fe<Fe2+ |
| C、Cl<Cl- |
| D、K+<Ca2+ |
 某有机物A的分子式为C10H20O2,已知A~E有如图转化关系.则A 的结构可能有( )
某有机物A的分子式为C10H20O2,已知A~E有如图转化关系.则A 的结构可能有( )| A、16种 | B、2种 | C、8种 | D、4种 |
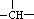 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)