题目内容
下列说法中正确的是( )
| A、某物质含有阿伏加德罗常数个微粒,该物质在标准状况下体积为22.4 L |
| B、在常温常压下,8 g O2中含有3.01×1023个O原子 |
| C、氧气和氢气的密度比为16:1 |
| D、只有在标准状况下,1 mol气体所占的体积才是22.4 L |
考点:物质的量的相关计算
专题:计算题
分析:A.选项中该物质不一定是气体,且选项中微粒不一定为分子;
B.根据n=
计算8g氧气的物质的量,氧原子物质的量为氧气的2倍,再根据N=nNA计算氧原子数目;
C.同温同压下,气体密度之比等于相对分子质量之比,但氧气和氢气不一定处于相同状况下;
D.物质的量一定时,影响气体体积因素有:温度,压强,非标准状况下,气体摩尔体积也可能是22.4L/mol.
B.根据n=
| m |
| M |
C.同温同压下,气体密度之比等于相对分子质量之比,但氧气和氢气不一定处于相同状况下;
D.物质的量一定时,影响气体体积因素有:温度,压强,非标准状况下,气体摩尔体积也可能是22.4L/mol.
解答:
解:A.某物质含有阿伏加德罗常数个微粒,该微粒的物质的量为1mol,选项中该物质不一定是气体,且选项中微粒不一定为分子,故该物质在标准状况下体积不一定为22.4 L,故A错误;
B.8g氧气的物质的量=
=0.25mol,氧原子物质的量为氧气的2倍,故含有氧原子数目=0.25mol×2×6.02×1023个mol-1=3.01×1023个,故B正确;
C.同温同压下,气体密度之比等于相对分子质量之比,氧气与氢气的密度之比=32:2=16:1,氧气和氢气不一定处于相同状况下,二者密度之比不一定是16:1,故C错误;
D.由PV=nRT可知,非标准状况下,气体摩尔体积也可能是22.4L/mol,非标况下1 mol气体所占的体积也可能是22.4 L,故D错误,
故选B.
B.8g氧气的物质的量=
| 8g |
| 32g/mol |
C.同温同压下,气体密度之比等于相对分子质量之比,氧气与氢气的密度之比=32:2=16:1,氧气和氢气不一定处于相同状况下,二者密度之比不一定是16:1,故C错误;
D.由PV=nRT可知,非标准状况下,气体摩尔体积也可能是22.4L/mol,非标况下1 mol气体所占的体积也可能是22.4 L,故D错误,
故选B.
点评:本题考查气体摩尔体积、微粒数目计算,比较基础,注意气体摩尔体积的使用条件与对象,根据PV=nRT理解阿伏伽德罗定律及其推论.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
生活处处有化学,下列相关叙述中正确的是( )
| A、为提高粮食产量,应大量使用化肥和农药 |
| B、人体缺钙会引起骨质疏松症,因此钙元素摄入得越多越好 |
| C、自行车支架上刷上油漆既美观又能防止钢铁生锈 |
| D、人可以食用含黄曲霉素的变质食物 |
 防治禽流感病毒目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是( )| A、莽草酸的分子之间可能发生酯化反应 |
| B、莽草酸的分子式为C7H4O5 |
| C、莽草酸中含有苯环 |
| D、莽草酸能使溴水褪色 |
下列物质间的转化可由一步反应完成的是( )
| A、SiO2→H2SiO3 |
| B、Cu(OH)2→Fe(OH)2 |
| C、CaCO3→Na2CO3 |
| D、Cu→Cu(NO3)2 |
下列因果关系叙述正确的是( )
| A、SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C、Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
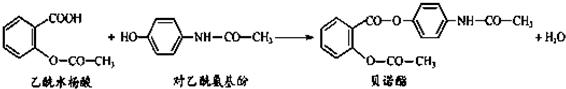
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A、贝诺酯分子中有三种含氧官能团 |
| B、对乙酰氨基酚核磁共振氢谱中共有四个峰 |
| C、乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应 |
| D、贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |