题目内容
下列溶液中各微粒的浓度关系正确的是( )
| A、1 L 0.1 mol?L-1CuSO4?(NH4)2SO4?6H2O的溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)>c(OH-) |
| B、0.2 mol?L-1NH4NO3和0.l mol?L-1 NaOH溶液等体积混合后:c(NO3-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、0.1 mol?L-1 NaHCO3溶液中:c(Na+)+c(H+)<c(HCO3-)+c(CO32-)+c(H2CO3)+c(OH-) |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:
分析:A.铵根离子部分水解,铜离子部分水解,溶液显示酸性,据此判断溶液中各离子浓度大小;
B.先判断反应后溶液中溶质组成为等浓度的一水合氨、硝酸铵、硝酸钠,一水合氨的电离程度大于其水解程度,则c(Na+)<c(NH4+);
C.根据碳酸氢钠溶液中的电荷守恒、碳酸氢根离子的水解程度大于其电离程度分析;
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中,HX的电离大于NaX的水解,溶液显示酸性.
B.先判断反应后溶液中溶质组成为等浓度的一水合氨、硝酸铵、硝酸钠,一水合氨的电离程度大于其水解程度,则c(Na+)<c(NH4+);
C.根据碳酸氢钠溶液中的电荷守恒、碳酸氢根离子的水解程度大于其电离程度分析;
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中,HX的电离大于NaX的水解,溶液显示酸性.
解答:
解:A.CuSO4?(NH4)2SO4?6H2O的物质的量为0.1mol,但在溶液中因铵根离子和铜离子的水解使溶液显酸性,则c(H+)>c(OH-),因铵根离子水解,则c(SO42-)>c(NH4+))>c(Cu2+),水解的程度很弱,则溶液中离子浓度大小为:c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-),故A错误;
B.0.2 mol?L-1NH4NO3和0.l mol?L-1 NaOH溶液等体积混合,反应后溶液中溶质为等浓度的硝酸铵、一水合氨、硝酸钠,溶液显示碱性,则c(OH-)>c(H+),一水合氨的电离程度大于铵根离子的水解程度,溶液显示碱性,则:c(OH-)>c(H+)、c(Na+)<c(NH4+),溶液中离子浓度大小为:c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故B错误;
C.因NaHCO3溶液不显电性,根据电荷守恒可得:①c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),由于碳酸氢钠显示碱性,则碳酸氢根离子的水解程度大于其电离程度,所以②c(CO32-)<c(H2CO3),将②代替①中1个碳酸根离子可得:c(Na+)+c(H+)<c(HCO3-)+c(CO32-)+c(H2CO3)+c(OH-),故C正确;
D、等体积、等物质的量浓度,则NaX和弱酸HX的物质的量相等,HX的电离大于NaX的水解,则c(X-)>c(Na+),正确的离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故D错误;
故选C.
B.0.2 mol?L-1NH4NO3和0.l mol?L-1 NaOH溶液等体积混合,反应后溶液中溶质为等浓度的硝酸铵、一水合氨、硝酸钠,溶液显示碱性,则c(OH-)>c(H+),一水合氨的电离程度大于铵根离子的水解程度,溶液显示碱性,则:c(OH-)>c(H+)、c(Na+)<c(NH4+),溶液中离子浓度大小为:c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故B错误;
C.因NaHCO3溶液不显电性,根据电荷守恒可得:①c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),由于碳酸氢钠显示碱性,则碳酸氢根离子的水解程度大于其电离程度,所以②c(CO32-)<c(H2CO3),将②代替①中1个碳酸根离子可得:c(Na+)+c(H+)<c(HCO3-)+c(CO32-)+c(H2CO3)+c(OH-),故C正确;
D、等体积、等物质的量浓度,则NaX和弱酸HX的物质的量相等,HX的电离大于NaX的水解,则c(X-)>c(Na+),正确的离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故D错误;
故选C.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,明确盐的水解原理及其应用方法为解答关键,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中离子浓度大小,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
某学生设计了如图的方法对X盐进行鉴别,由此分析,下列结论中正确的是( )
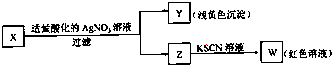

| A、加入适量酸化的AgNO3溶液只发生复分解反应 |
| B、X中一定有Fe3+ |
| C、将操作顺序调换,现象一致,可判断X为FeBr3 |
| D、X一定为FeBr2溶液 |
下列物质不属于天然高分子化合物的是( )
| A、淀粉 | B、纤维素 |
| C、油脂 | D、蛋白质 |
检验某未知溶液中是否含有SO42-,下列操作最合理的是( )
| A、先加稀硝酸酸化,再加入Ba(NO3)2溶液 |
| B、加BaCl2溶液即可 |
| C、先加盐酸酸化,再加BaCl2溶液 |
| D、加Ba(NO3)2溶液即可 |
下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学防护 ⑤电泳 ⑥电化学腐蚀 ⑦电冶金.
①电离 ②电镀 ③电解 ④电化学防护 ⑤电泳 ⑥电化学腐蚀 ⑦电冶金.
| A、全部 | B、②④⑤ |
| C、②③⑤⑦ | D、②③④⑥ |
室温下,0.1mol/L氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是 ①电离度增大 ②C(OH-)增大 ③C(H+]增大 ④KW 增大⑤导电性增强 ⑥
增大( )
| c(OH-) |
| c(NH3?H2O) |
| A、①②③ | B、①③⑤ |
| C、①③⑥ | D、②④⑥ |
下列有关氯水的叙述,正确的是( )
| A、新制氯水可使无色酚酞试纸先变红,后褪色 |
| B、新制的氯水只含Cl2和H2O分子 |
| C、氯水放置数天后,酸性增强 |
| D、光照氯水有气泡逸出,该气体是Cl2 |
下列有关化学用语正确的是( )
A、O原子的电子排布图为  |
| B、氯化钠的分子式:NaCl |
C、Cl-的结构示意图: |
| D、Ca原子的电子排布式为 1s22s22p63s23p63d2 |