题目内容
6.一个体重50kg的健康人含Fe元素约2g.主要以Fe2+、Fe3+形式存在于人体内.Fe2+易被吸收,给贫血者补充铁时,应补充Fe2+的亚铁盐(如FeSO4),服用Vitc,可使食物中的Fe3+转化为Fe2+. 人体中经常进行Fe2+ $?_{B}^{A}$Fe3+的转化,在过程A中,Fe2+做D剂.Vitc使Fe3+转化为Fe2+,Vitc在这一过程中做B,在此反应中Fe3+体现了C性.(从下面的选项中选择答案并将序号填在横线上)A.氧化剂 B.还原剂 C.氧化 D.还原.
分析 过程A中Fe元素的化合价升高,过程B中Fe元素的化合价降低,Vitc使Fe3+转化为Fe2+,Fe元素的化合价降低,则Vitc在这一过程中某元素的化合价升高.氧化剂化合价降低,具有氧化性;还原剂化合价升高,具有还原性.
解答 解:过程A中Fe元素的化合价升高,则Fe2+做还原剂;过程B中Fe元素的化合价降低,则Fe3+作氧化剂,被还原,Vitc使Fe3+转化为Fe2+,Fe元素的化合价降低,则Vitc在这一过程中某元素的化合价升高,则作还原剂,具有还原性,
故答案为:D; B; C.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和应用能力的考查,明确反应中元素的化合价变化是解答的关键,题目难度不大.

练习册系列答案
相关题目
1.实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液,完成下列表格
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2-3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶.
(4)若出现如下情况,对所配溶液浓度的影响是(填偏大、偏小、不变):没有进行
A操作时浓度偏小;加蒸馏水时不慎超过了刻度线时浓度偏小;定容时俯视时浓度偏大_.
(1)配制250mL0.1mol/L的盐酸溶液,完成下列表格
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格 | 除容量瓶、小烧杯、玻璃棒、胶头滴管外还需要的其它玻璃仪器 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2-3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶.
(4)若出现如下情况,对所配溶液浓度的影响是(填偏大、偏小、不变):没有进行
A操作时浓度偏小;加蒸馏水时不慎超过了刻度线时浓度偏小;定容时俯视时浓度偏大_.
11.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol•L-1CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol•L-1NH4HCO3溶液中通CO2:c(NH4+)═c(HCO3-)+c(CO32-) | |
| C. | 向0.10mol•L-1NaHSO3溶液中通NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| D. | 向0.10mol•L-1 Na2SO3溶液中通SO2:c(Na+)═2[c(HSO3-)+c(SO32-)+c(H2SO3)] |
16.下列关于科学家及其提出学说、贡献的叙述错误的是( )
| A. | 道尔顿提出原子学说 | |
| B. | 门捷列夫提出了元素周期律 | |
| C. | 汤姆生发现电子,并提出原子结构轨道模型 | |
| D. | 舍勒发现了氯气 |
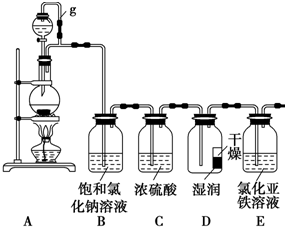 某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题: 某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:
某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸: ,氧元素在周期中的位置是第二周期第VIA族.
,氧元素在周期中的位置是第二周期第VIA族.